
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用稀硫酸除去铁锈:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 复分解反应 | |
| B. | 电解水时,两极均产生气泡:2H2O $\frac{\underline{\;电解\;}}{\;}$2H2+O2↑ 分解反应 | |
| C. | 实验室制取二氧化碳:CaCO3+HCl═CaCl2+H2O+CO2↑ 中和反应 | |
| D. | 用磁铁矿炼铁:4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是初中化学中常见物质间的转化关系,常温下,A、B、E为气体,C、D为液体;A、B能产生温室效应,D、E是人类生命活动的必需物质,图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,反应条件,部分反应物和生成物已略去.
如图是初中化学中常见物质间的转化关系,常温下,A、B、E为气体,C、D为液体;A、B能产生温室效应,D、E是人类生命活动的必需物质,图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,反应条件,部分反应物和生成物已略去.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
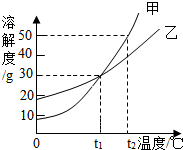
| A. | t1℃时,甲、乙100g饱和溶液中,均含溶质30g | |
| B. | 将甲和乙的t1℃时的饱和溶液升温到t2℃,甲溶液中溶质的质量分数比乙大 | |
| C. | t2℃时,甲的饱和溶液中溶质的质量分数为50% | |
| D. | 将甲的饱和溶液变为不饱和溶液可采用降温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
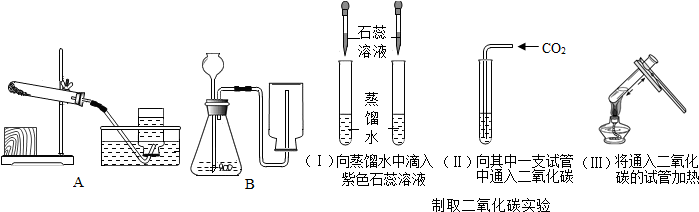
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 现象 | 结论 |
| ①将足量铁粉与锌粉分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:Fe<Zn | 反应速率与反应物的金属活动性强弱有关 |
| ②将等质量锌粉与锌片分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:锌粉>锌片 | 反应速率与反应物的接触面积大小有关 |
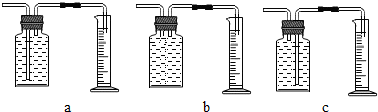
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com