
如图所示的一个密闭叉形玻璃管,在支管A中放入mg锌粉,在支管B中放入固体KMnO4.将A、B两支管同时加热,使支管内物质都完全反应.
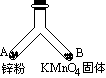
(1)写出A、B两支管内发生反应的化学方程式.
(2)若反应前后叉形管内空气成分不发生变化,则最初放入支管B的固体KMnO4是多少克?(写出计算过程,保留2位小数)
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:初中化学 来源:课堂三级讲练化学 九年级(上) 题型:038
如图所示的一个密闭叉形玻璃管,在支管A中放入m g锌粉,在支管B中放入固体高锰酸钾.将A、B两支管同时加热,使支管内物质都完全反应.
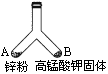
(1)写出A、B两支管内发生反应的化学方程式.
(2)若反应前后叉形管内空气成分不发生变化,则最初放入支管B的固体高锰酸钾是多少克?(保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com