把20g不纯的碳酸钾固体(其中杂质不溶于水)放入86.2g水中,充分搅拌,使固体中的碳酸钾完全溶解,过滤,取10g滤液,向其中滴加适量的稀硫酸至不再产生气泡,放出气体0.44g.试计算:
(1)完全反应时,溶液中钾离子和硫酸根离子的个数比是______.
(2)所取10g滤液中溶质的质量分数.
【答案】
分析:(1)依据碳酸钾和稀硫酸完全反应时会生成硫酸钾水和二氧化碳分析溶液中钾离子和硫酸根离子的关系;
(2)依据二氧化碳的质量依据化学方程式可求出反应的碳酸钾的质量,进而可得所取10g滤液中溶质的质量分数.
解答:解:(1)依据碳酸钾和稀硫酸完全反应时所得的溶液是硫酸钾的溶液,其方程式是K
2CO
3+H
2SO
4=K
2SO
4+H
2O+CO
2↑,则可知反应后的溶液中钾离子和硫酸根离子的个数比是2:1,;
(2)设所取10g滤液中溶质的质量是x
K
2CO
3+H
2SO
4=K
2SO
4+H
2O+CO
2↑
138 44
x 0.44g,
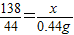
x=1.38g
所以所取10g滤液中溶质的质量分数为:
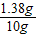
×100%=13.8%
故答案为:(1)2:1 (2)所取10g滤液中溶质的质量分数为13.8%;
点评:本题考查学生利用化学反应方程式进行计算的能力,掌握有关化学方程式计算的基本步骤以及溶质质量分数的计算是解题的关键;

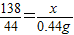
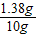 ×100%=13.8%
×100%=13.8%
