
| A. | 实验室制取气体时,先检查装置气密性,后装药品 | |
| B. | 稀释浓硫酸时,向烧杯中先倒入浓硫酸,后倒入水 | |
| C. | 加热KClO3制取O2的实验结束时,先从水中移出导管,后熄灭酒精灯 | |
| D. | 加热试管内药品时,先使试管均匀受热,后集中在药品部位加热 |
分析 A、凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
B、根据稀释浓硫酸的注意事项进行分析判断;
C、利用加热的方法制取气体,并且利用排水法收集气体时,要按照一定的步骤进行,特别是要注意集满气体后的操作顺序,以防发生安全事故;
D、先给试管均匀加热,再对着药品集中的部位加热,防止受热不均,造成试管炸裂.
解答 解:A、实验室制取气体时,要先检查装置的气密性,后加入试剂进行反应,以防装置漏气影响实验结果,该选项说法正确;
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,一定不能把水注入浓硫酸中,故选项说法错误;
C、利用氯酸钾制氧气的实验结束时,要先把导气管从水槽中取出,后熄灭酒精灯,以防水倒流入试管,把试管炸裂,该选项说法正确;
D、先给试管均匀加热,再对着药品集中的部位加热,防止受热不均,造成试管炸裂,故选项说法正确;
故选B.
点评 理解操作方法先后进行的原因,可以更好地掌握操作,对解答此类问题尤其重要.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
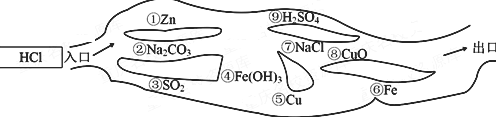
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
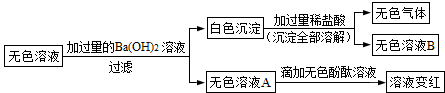
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
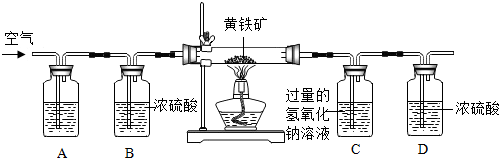
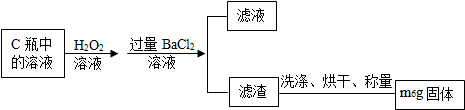
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com