
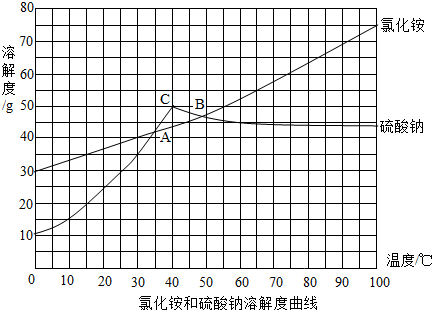


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
(2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.| 实验步骤 | 实验现象 | 结论 |
| ①取样,加足量的水 | 固体完全溶解 | 没有不溶性杂质 没有不溶性杂质 |
| ②用试管取上述试液,加入过量,塞上带导管的单孔塞;将导管的另一端插入盛有 澄清石灰水的 澄清石灰水的 烧杯中 |
澄清石灰水变浑浊 澄清石灰水变浑浊 |
原固体混合物中含有 |
| ③再向试管中加入 | 有白色沉淀生成 | 原固体烧碱中含有 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 某校学生对买来的工业固体烧碱的杂质成分进行研究.
某校学生对买来的工业固体烧碱的杂质成分进行研究.
[查阅资料]
①在化工生产中,原料往往不能全部转化成产品.
②在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).工业上用电解饱和食盐水制烧碱的化学方程式为.
[实验假设]
该工业固体烧碱中可能含有氯化钠、碳酸钠,导致该工业固体烧碱中含有碳酸钠杂质的原因可能是(用化学方程式回答).
[实验设计]
他们设计了实验方案来验证上述假设.
请你帮助他们完成实验报告:
| 实验步骤 | 实验现象 | 结论 |
| ①取样,加足量的水 | 固体完全溶解 | ________ |
| ②用试管取上述试液,加入过量,塞上带导管的单孔塞;将导管的另一端插入盛有________烧杯中 | ________ | 原固体混合物中含有 |
| ③再向试管中加入 | 有白色沉淀生成 | 原固体烧碱中含有 |
[产品分析]
取该工业固体烧碱样品46.91克(只含两种杂质)加人足量蒸馏水,向所得溶液中先滴加2-3滴;再滴加7.3%的稀盐酸至溶液颜色恰好由红色变为无色,共用去稀盐酸510克.
①实验过程中开始滴加稀盐酸无气泡出现的原因是.
②欲测定样品中所含各物质的质量分数,则除以上数据外还需测定出反应过程中产生的二氧化碳的质量,若二氧化碳的质量为0.44克,则样品中氯化钠的质量分数为多少?(要有计算过程,保留小数点后两位数字)
[反思与应用]
利用电解水实验研究水的组成时可以向水中加稀硫酸或氢氧化钠以增强水的导电性,能否向水中加该工业固体烧碱样品?(填“能”或“不能”)
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
某校学生对买来的工业固体烧碱的杂质成分进行研究.
[查阅资料]
①在化工生产中,原料往往不能全部转化成产品.
②在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(C12).工业上用电解饱和食盐水制烧碱的化学方程式为.
[实验假设]
该工业固体烧碱中可能含有氯化钠、碳酸钠,导致该工业固体烧碱中含有碳酸钠杂质的原因可能是(用化学方程式回答).
[实验设计]
他们设计了实验方案来验证上述假设.
请你帮助他们完成实验报告:
| 实验步骤 | 实验现象 | 结论 |
| ①取样,加足量的水 | 固体完全溶解 |
|
| ②用试管取上述试液,加入过量,塞上带导管的单孔塞;将导管的另一端插入盛有 烧杯中 |
| 原固体混合物中含有 |
| ③再向试管中加入 | 有白色沉淀生成 | 原固体烧碱中含有 |
[产品分析]
取该工业固体烧碱样品46.91克(只含两种杂质)加人足量蒸馏水,向所得溶液中先滴加2﹣3滴;再滴加7.3%的稀盐酸至溶液颜色恰好由红色变为无色,共用去稀盐酸510克.
①实验过程中开始滴加稀盐酸无气泡出现的原因是.
②欲测定样品中所含各物质的质量分数,则除以上数据外还需测定出反应过程中产生的二氧化碳的质量,若二氧化碳的质量为0.44克,则样品中氯化钠的质量分数为多少?(要有计算过程,保留小数点后两位数字)
[反思与应用]
利用电解水实验研究水的组成时可以向水中加稀硫酸或氢氧化钠以增强水的导电性,能否向水中加该工业固体烧碱样品?(填“能”或“不能”)
查看答案和解析>>
科目:初中化学 来源: 题型:
21世纪是海洋开发与利用的世纪。烟台的“十二五”规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水淡化:蒸馏法淡化海水是利用海水中各成份的 不同分离出淡水;高压反渗透膜法淡化海水是利用海水中各成份的 不同分离出淡水。
(2)制盐:①制粗盐。从卤水中提取粗盐用的结晶方法是 。②粗盐纯化。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后通过如下操作即可得到较纯的氯化钠:a过滤.b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是 (填字母)。
(3)制碱:氨碱法制纯碱的流程图如下:

完成图中“( )”的内容:① ;② ;③ 。
(4)制镁:工业上一般用电解熔融状态的氯化镁制金属镁,若以卤水(含有硫酸镁、氯化钠和氯化钙)为起始原料来制取金属镁,请画出制镁的流程图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com