
| A. | 8:7 | B. | 7:8 | C. | 4:7 | D. | 1:2 |
分析 根据铜和硝酸银反应生成硝酸铜和银,铁和硝酸银反应生成硝酸亚铁和银,依据固体质量的改变进行分析.
解答 解:设混合物中铜的质量为x,则铁的质量为(8.8-x)
Cu+2AgNO3=Cu(NO3)2+2Ag
64 216
x $\frac{216x}{64}$
Fe+2Ag(NO3)2=Fe(NO3)2+2Ag
56 216
8.8-x $\frac{216(8.8-x)}{56}$
所以$\frac{216x}{64}$+$\frac{216(8.8-x)}{56}$=32.4g
x=3.2g
所以混合粉末中铜粉和铁粉的质量比为3.2g:(8.8g-3.2g)=4:7
故选:C.
点评 不同主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
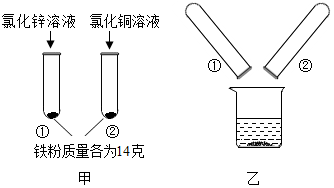 为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )
为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )| A. | 甲图试管①中溶液颜色发生改变 | |
| B. | 甲图试管②中的溶液中含有FeCl3 | |
| C. | 乙图烧杯中的溶液一定只含有两种溶质 | |
| D. | 乙图烧杯中最后所得固体的质量可能等于3.2g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 请根据如图标签的信息回答:
请根据如图标签的信息回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com