4.目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础.
(一) 铁的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理Fe+CuSO
4═FeSO
4+Cu.
(2)铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料
可制作耐酸防护服材料.其中的不锈钢丝属于 (填“属于”或“不属于”)金属材料.
(3)某品牌的麦片中含微量铁粉,食用后可在胃酸 (主要成分是盐酸) 的作用下转化为人
体可吸收的铁元素,反应的化学方程式为Fe+2HCl═FeCl
2+H
2↑.因此食
用该麦片还可预防缺铁性贫血.
(二) 铁的性质探究
(1)能被磁铁吸引的物质一定是铁单质吗?
【实验验证】①将细铁丝在纯氧中完全燃烧,主要反应的化学方程式为3Fe+2O
2$\frac{\underline{\;点燃\;}}{\;}$Fe
3O
4.
②将反应后的黑色固体用磁铁检验,能被吸引.
【实验结论】能被磁铁吸引的物质不一定(填“一定”或“不一定”) 是铁单质.
(三) 炼铁过程的探究
(1)写出工业上用赤铁矿炼铁主要原理的化学方程式Fe
2O
3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO
2.
【查阅资料】用CO还原Fe
2O
3炼铁的过程大致分
为三个阶段:500~600℃
阶段1:3Fe2O3+CO$\frac{\underline{\;500~600℃\;}}{\;}$2Fe
3O
4+CO
2阶段2:Fe
3O
4+CO $\frac{\underline{\;600~700℃\;}}{\;}$3FeO+CO
2阶段3:FeO+CO$\frac{\underline{\;700℃\;}}{\;}$ Fe+CO
2(2)在钢铁厂的实验室,同学们采集了用某种热分析仪记录的CO与Fe
2O
3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线,如图1所示.则图中M点对应的a=18.0.
(四) 炼铁过程的思考
(1)据资料统计显示,2013年我国粗钢产量已近8亿吨.若用含氧化铁80%的赤铁矿炼铁,生产8.4亿吨铁,至少产生多少亿吨二氧化碳?需这样的赤铁矿石多少亿吨?
(2)大气中CO
2含量增加会导致“温室效应”加剧,科学家认为,人类不仅要努力减少CO
2的排放,更重要的是将CO
2转化为有用物质.如将CO
2转化为化工原料乙烯(C
2H
4),其反应的微观过程如图2所示:
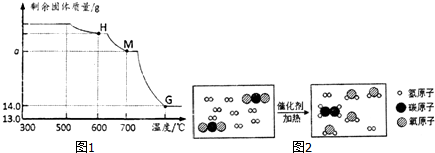
请写出上述反应的化学方程式:2CO
2+6H
2$\frac{\underline{催化剂}}{△}$C
2H
4+4H
2O.


 阅读快车系列答案
阅读快车系列答案 探究燃烧条件的实验装置如图所示:
探究燃烧条件的实验装置如图所示:
