
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀盐酸的质量 | 10g | 10g | 10g | 10g |
| 剩余固体的质量 | 3.0g | 2.0g | 1.0g | 0.4g |
分析 (1)通过比较每10g稀盐酸碳后酸钙减少的质量来确定反应是否完全进行.
(2)由样品质量和杂质质量就可以计算出样品中碳酸钙的质量分数.
(3)根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,利用溶质质量分数公式计算该稀盐酸的质量分数;根据实验数据,前三次所加入的稀盐酸都完全发生了反应,在计算稀盐酸的溶质质量分数时可使用前三次的实验数据.
(4)根据反应的化学方程式,计算氯化钙的质量,进一步计算最后所得溶液中氯化钙的质量分数.
解答 解:(1)比较第加入一、二、三次的数据可知:10g盐酸完全反应可以消耗碳酸钙3.0g-2.0g=1g;第四次中仅减少了1.0g-1.4g=0.6g,没有减少到1g,说明此时碳酸钙已完全反应,样品中含有0.4g杂质.
(2)样品中碳酸钙的质量分数为 $\frac{4g-0.4g}{4g}$×100%=90%
(3)设与1克碳酸钙反应的HCl的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
1g x
$\frac{100}{1g}=\frac{73}{x}$
X=0.73g
所以稀盐酸中溶质的质量分数为:$\frac{0.73g}{10g}$×100%=7.3%.
(4)设完全反应生成的氯化钙的质量为y,生成二氧化碳质量为z,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
4g-0.4g y z
$\frac{100}{4g-0.4g}=\frac{111}{y}$
y=3.996g
$\frac{100}{4g-0.4g}=\frac{44}{z}$
z=1.584g
最后所得溶液中氯化钙的质量分数为$\frac{3.996g}{(4g-0.4g)+40g-1.584g}×100%$=9.5%
答:(1)第4次石灰石样品中碳酸钙完全反应,(2)该石灰石样品碳酸钙的质量分数是90%.
(3)所用稀盐酸的溶质质量分数是7.3%.(4)最后所得溶液中氯化钙的质量分数为9.5%.
点评 根据反应进行溶液溶质质量分数计算时,一定要选取溶液中溶质完全反应时的数据计算溶液中溶质的质量,这样求得的溶质质量分数才是溶液的溶质质量分数.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 空气中物质的含量$\frac{C{O}_{2}、{N}_{2}、{O}_{2}}{由少到多}$ | |
| B. | 硫元素化合价$\frac{{H}_{2}S、S{O}_{2}、NaHS{O}_{4}}{由低到高}$ | |
| C. | 人体中的元素含量$\frac{Se、Fe、H}{由低到高}$ | |
| D. | 铜元素的质量分数$\frac{C{u}_{2}O、CuO、CuS}{由低到高}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 某元素的原子结构示意图如图所示,下列说法不正确的是( )
某元素的原子结构示意图如图所示,下列说法不正确的是( )| A. | 该元素化学性质与第三层的电子数目密切相关 | |
| B. | 该元素是一种非金属元素 | |
| C. | 该元素原子的核外电子数为6 | |
| D. | 该元素原子在化学反应中易得到电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
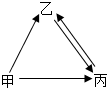 甲、乙、丙三种物质均含地壳中含量最多的元素.甲、乙是组成元素相同的化合物,丙是单质;甲、乙在常温下均为液体,在一定条件下均可分解成丙;它们之间有如图所示的转化关系(部分物质和反应条件已经略去).
甲、乙、丙三种物质均含地壳中含量最多的元素.甲、乙是组成元素相同的化合物,丙是单质;甲、乙在常温下均为液体,在一定条件下均可分解成丙;它们之间有如图所示的转化关系(部分物质和反应条件已经略去).查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 已知A、B、D、E、F、M是初中化学常见的几种物质,它们间有如图的转变关系(反应条件未标出).通常情况下A是黑色固体单质,B、D是气体单质,E、F都是氧化物,M是天然气的主要成分.
已知A、B、D、E、F、M是初中化学常见的几种物质,它们间有如图的转变关系(反应条件未标出).通常情况下A是黑色固体单质,B、D是气体单质,E、F都是氧化物,M是天然气的主要成分.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | KCl( KClO3 ) | 少量MnO2 | 加热 |
| B | NaOH(NaCl) | 适量稀盐酸 | 蒸发、结晶 |
| C | CO2(CO) | 足量O2 | 点燃 |
| D | 稀盐酸(稀硫酸) | 适量氯化钡溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化学可以为人类研制新材料 | |
| B. | 化学可以为人类研制新能源 | |
| C. | 化学会在环境保护中发挥重要作用 | |
| D. | 化学的发展必然导致生态环境的恶化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com