
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再用滴管滴加______,充分反应后,静置,弃去清液得到固体. | 固体粉末______, 并有______. | 仅除去铝 |
| ② | 再往大试管中加______,充分反应. | 固体______, 溶液______. | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
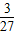 =2.7g,因此该种粉末中含铝的质量分数小于50%;故C正确;
=2.7g,因此该种粉末中含铝的质量分数小于50%;故C正确;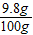 ×100%=9.8%,因此当粉末为Al、Fe时,所需稀硫酸溶质质量分数一定大于9.8%;故D正确;
×100%=9.8%,因此当粉末为Al、Fe时,所需稀硫酸溶质质量分数一定大于9.8%;故D正确;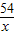 =
=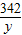 =
=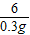
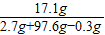 ×100%=17.1%
×100%=17.1%| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| 足量(或过量)的NaOH溶液 | 部分溶解 气泡放出 | ||
| 足量(或过量)的稀硫酸(或稀盐酸) | 部分溶解,气泡放出 呈浅绿色 |
 ×金属的质量,熟练掌握这种计算氢气的方法,对于解决此类选择性计算会较为方便.
×金属的质量,熟练掌握这种计算氢气的方法,对于解决此类选择性计算会较为方便. 

 口算题天天练系列答案
口算题天天练系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再用滴管滴加 |
固体粉末 并有 |
仅除去铝 |
| ② | 再往大试管中加 |
固体 溶液 |
证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 足量(或过量)的NaOH溶液 足量(或过量)的NaOH溶液 ,充分反应后,静置,弃去清液得到固体. |
固体粉末 部分溶解 部分溶解 ,有 气泡放出 气泡放出 . |
仅除去铝 |
| ② | 再往大试管中加 足量(或过量)的稀硫酸(或稀盐酸) 足量(或过量)的稀硫酸(或稀盐酸) ,充分反应. |
固体 部分溶解并有气泡放出 部分溶解并有气泡放出 ,溶液 呈浅绿色 呈浅绿色 . |
证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
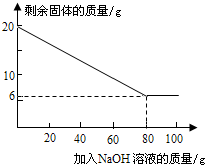
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气
(2Al+2H2O+2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、Na0H溶液、氨水。
请你参与并完成以下实验探究过程:
Ⅰ、提出假设 假设1:该混合金属粉末中除铝外还含有Fe。
假设2:该混合金属粉末中除铝外还含有 _________。
假设3:该混合金属粉末中除铝外还含有Fe、Cu。
Ⅱ、设计并实施实验方案
(1)基于假设1,不用化学试剂,证明金属铁的存在可用 ____________ 。
(2)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是
_____________,反应的化学方程式为 ___________。
(3)基于假设3,请你完成实验操作,描述实验现象。
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再用滴管滴加 ,充分反应后,静置,弃去清液得到 固体。 | 固体粉末 , 并有 。 | 仅除去铝 |
| ② | 再往大试管中加 ,充分反应。 | 固体 , 溶液 。 | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
Ⅲ、已知该金属粉末的组成为铝和铁、铝和铜两种情况。
(1)为测定混合金属粉末中铝的质量分数,将5.6 g的金属粉末中加入100 g某溶质质量分数的稀硫酸,恰好完全反应,并产生a g氢气,则下列说法正确的是 ( )
A.当粉末为Al 、Fe时,a可能为0.2 g
B.当粉末为Al、Cu时,反应完全后,生成物的溶液里一定含有Al2(SO4)3和CuSO4
C.当粉末为Al、Cu时,若a为0.3g,则该种粉末中含铝的质量分数小于50%
D.当粉末为Al、Fe时,所需稀硫酸溶质质量分数一定大于9.8%
(2)若5.6 g粉末为铝和铜,加入97.6 g足量的稀硫酸,完全反应生成氢气0.3 g,求所得Al2(SO4)3溶液质量分数(Al2(SO4)3相对分子质量为342,要求有计算过程。
查看答案和解析>>
科目:初中化学 来源:2008-2009学年江苏省扬州市九年级(上)期末化学试卷(解析版) 题型:解答题
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再用滴管滴加______,充分反应后,静置,弃去清液得到固体. | 固体粉末______, 并有______. | 仅除去铝 |
| ② | 再往大试管中加______,充分反应. | 固体______, 溶液______. | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com