
【题目】早在春秋战国时期,我国就开始生产和使用铁器。工业炼铁把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
一氧化碳还原氧化铁的化学方程式为: 。其中,石灰石起的作用是 。
(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为 。为什么工业上不用焦炭作为还原剂直接还原铁矿石?
【猜想与假设】
焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【进行实验】
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。
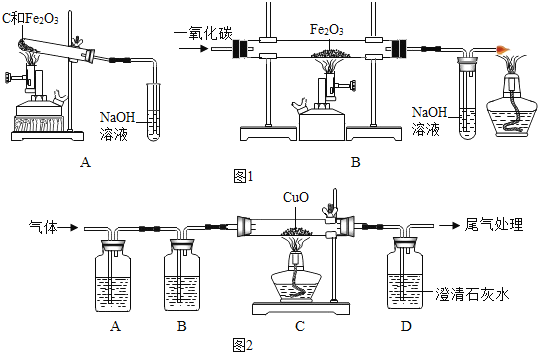
②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先 (选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是 。
【实验现象】
当图1装置B的玻璃管中固体完全由 时(选填“红色变为黑色”或“黑色变为红色”),图1装置A的试管中仍有 。
【解释与结论】
焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【完善实验】
联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过图2的检验装置。图2A装置中的试剂是(写名称,下同) ,图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式 ;证明原混合气体中CO存在的实验现象是 ;经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。
(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】
利用绿矾制备精还原铁粉的工艺流程如下:
![]()
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为
FexOy+yH2![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2![]() 3Fe+CH4。
3Fe+CH4。
【含量测定】
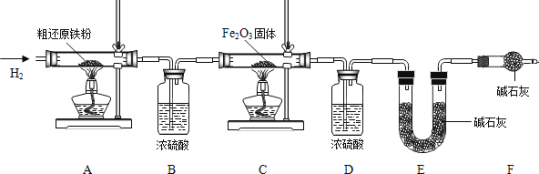
为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。
已知3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(1)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃酒精灯, (填“先点A处,后点C处”或“先点C处,后点A处”);
④分别熄灭A处、C处酒精灯;
⑤再缓缓通入少量H2;
⑥再次称量必要装置的质量
(2)步骤②的目的是 ,验证该步骤目的达到的实验方法是 ;
(3)若缺少装置D,则所测氧元素的质量分数将 (填“偏大”,“偏小”或“不变”)。
(4)粗还原铁粉样品的质量为15.000g,装置B、E分别增重0.270g和0.330g,则计算样品出中碳、氧元素的质量分数分别是 。(列出计算过程,2分)
【答案】3CO+Fe2O3![]() 2Fe+3CO2;将矿石中的二氧化硅等杂质转变为炉渣而除去的。
2Fe+3CO2;将矿石中的二氧化硅等杂质转变为炉渣而除去的。
(一)【提出问题】3C+2Fe2O3高温4Fe+3CO2↑
【进行实验】②通CO;防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化。
【实验现象】红色变为黑色;红色物质。
【完善实验】澄清石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;黑色粉末变成红色。
(二)(1)③先点C处,后点A处。(2)排尽空气,防止爆炸;收集尾气,进行验纯。
(3)不变(4)w(C)=0.6%;w(O)=1.6%。
【解析】
试题分析∶根据所学知识和题中信息知,工业炼铁把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为:3CO+Fe2O3高温2Fe+3CO2;其中,石灰石起的作用是将矿石中的二氧化硅等杂质转变为炉渣而除去的。(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。【提出问题】单质碳也具有还原性,碳还原氧化铁的化学方程式为3C+2Fe2O3高温4Fe+3CO2↑。为什么工业上不用焦炭作为还原剂直接还原铁矿石?【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。【进行实验】①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先通CO;实验结束后应继续通入CO直至冷却至室温,其原因是防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化。【实验现象】当图1装置B的玻璃管中固体完全由红色变为黑色时;图1装置A的试管中仍有红色物质。【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。【完善实验】甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过图2的检验装置。图2A装置中的试剂是澄清石灰水;图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式是Ca(OH﹚2+CO2=CaCO3↓+H2O;证明原混合气体中CO存在的实验现象是黑色粉末变成红色。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+yH2高温xFe+yH2O,Fe3C+2H2高温3Fe+CH4。【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。已知3CH4+4Fe2O3高温3CO2+6H2O+8Fe(1)主要实验步骤如下:①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②缓缓通入纯净干燥的H2;③点燃酒精灯,先点C处,后点A处。④分别熄灭A处、C处酒精灯;⑤再缓缓通入少量H2;⑥再次称量必要装置的质量。(2)步骤②的目的是排尽空气,防止爆炸;验证该步骤目的达到的实验方法是收集尾气,进行验纯。(3)若缺少装置D,则所测氧元素的质量分数将不变。(4)粗还原铁粉样品的质量为15.000g,装置B、E分别增重0.270g和0.330g,则计算样品出中碳、氧元素的质量分数分别是∶0.330g×﹙12/44×100%﹚/15.0g×100%=0.6%;0.270g×﹙16/18×100%﹚/15.0g×100%=1.6%。
考点∶考查实验探究的基本思路和方法。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:初中化学 来源: 题型:
【题目】阅读自来水厂净水过程示意图1,回答以下问题:
(1)净水过程中发生化学变化的环节是_____(填正确选项前的字母);
A、过滤 B、吸附 C、投药 D、配水
(2)通常向清水池投放高铁酸钠(化学式为Na2FeO4)杀菌消毒,高铁酸钠中铁元素的化合价为_____;
(3)我国有关部门规定,经上述流程净化后进入用户的饮用水含铁<0.3mgL﹣1,含铜<1.0mgL﹣1,….其中的“铁、铜”指的是_____ (填序号).
A、原子 B、分子 C、离子 D、元素.
(4)地球是一个富含水的星球,但可利用淡水资源却极为有限,所以节约用水应成为一种生活习惯.如图2中属于节水标志的是_____.

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】太阳能吸附式制冷结露法空气取水器可用于野外获取淡水,工作原理如下图所示。

(1)蒸发冷凝器中发生的是_______(填“物理”“化学”)变化。
(2)吸附剂中主要物质为SiO2和CaCl2,SiO2中硅元素的化合价为________,CaCl2中钙、氯元素的质量比为________。
(3)如下图所示,电子秤上的量筒中盛有蒸馏水,放置一段时间,电子秤示数变小,从微粒的角度解释其原因是______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映其对应变化关系的是( )
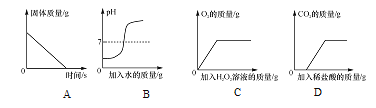
A. 加热一定质量的碳酸氢钠固体
B. 向盛有少量硫酸溶液的烧杯中滴加一定质量的水
C. 向盛有一定质量二氧化锰的烧杯中加入过氧化氢溶液
D. 向盛有一定质量NaOH和Na2CO3混合溶液的烧杯中滴加稀盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOH热浓硫酸H2O+CO↑,下列说法错误的是
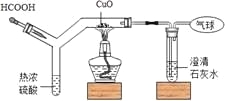
A. 实验中所需CO可现制现用
B. 此装置可节约用品,污染小,现象明显
C. 此装置内空间较小,空气易排空,实验危险系数小
D. 该实验中所涉及反应的基本类型有分解反应和置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的生活和工农业生产都离不开水,下图是自来水厂净水过程示意图。
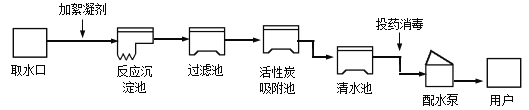
(1)自来水厂生产自来水时,使用的净水方法有___________________;
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)取水后加入絮凝剂(明矾)的作用是____________________;
(3)自来水厂常用二氧化氯进行投药消毒,二氧化氯的化学式为_______________;漂白粉(有效成分为次氯酸钙)也可用为饮水消毒剂,次氯酸钙[Ca(ClO)2]中氯元素的化合价为______________。
(4)上图吸附池内的活性炭起吸附作用,经沉淀、过滤等净化处理后所得的水_______纯水(填“是”或“不是”)。
(5)家庭生活中可以用____________检验某水样是硬水还是软水。
(6)加入活性炭的作用是_____________________。
(7)实验室中,沉淀、过滤、吸附、蒸馏等操作中可以降低水硬度的是_____________。
(8)有些科学家预言:“世界上最后一滴水就是人类的眼泪”。这句话警示我们应树立保护水资源的意识:一是节约用水,二是防止水体污染。请你举一例节约用水的做法:_______________(合理答案均可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料在生产、生活中有着广泛的应用。
(1)人类每年从自然界开采大量的金属,其中开采量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为_____________________________。
(2)北京奥运会用到多种材料。下列应用中使用金属材料的有__________(填序号)。
①使用金、银和铜等制作奖牌 ②使用纯羊毛和聚酯纤维制作“福娃”
③使用新型钢材建造“鸟巢” ④使用聚氟乙烯制造“水立方”外层膜
(3)金属矿物的储量有限,而且不能再生,所以保护金属资源尤为重要。保护金属资源的有效途径是________________________________________(答出两条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下:
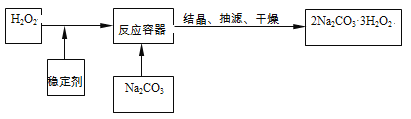
请回答下列问题:
⑴H2O2在催化或受热条件下易分解,其化学方程式为______________________;在上述流程中,向反应前的H2O2中加入稳定剂的作用是______________________。
⑵在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是_______(填序号)。
A.二氧化锰 B.稀盐酸 C.硫酸钠 D.石灰水
⑶“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3·3H2O2)![]() 4Na2CO3+6H2O+3O2↑
4Na2CO3+6H2O+3O2↑
请通过计算说明:①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是____?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,需加水的质量是________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中![]() 分别表示三种不同的分子,它们在一定条件下反应,前后的变化如图所示:下列叙述错误的是( )
分别表示三种不同的分子,它们在一定条件下反应,前后的变化如图所示:下列叙述错误的是( )
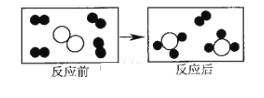
A. 反应前和反应后都是混合物
B. 该反应既不是化合反应也不是分解反应
C. 化学反应前后分子的种类发生改变
D. 化学反应前后原子的种类和个数没有改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com