
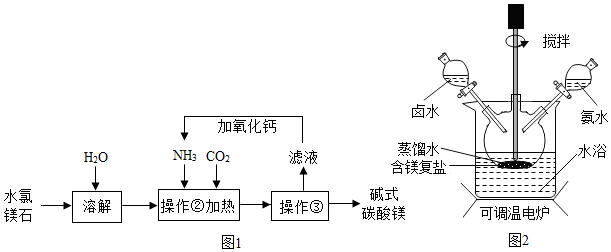
分析 (1)操作③的名称是过滤,通过过滤能够把固体和液体分离;
(2)加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气;
(3)氯离子能和银离子结合成不溶于稀硝酸的白色沉淀氯化银;
(4)反应物接触越充分,分解速率越快;
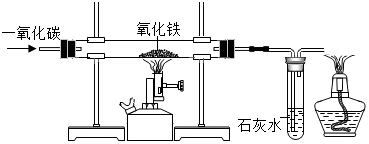
(5)浓硫酸具有吸水性,可以用作某些气体的干燥剂;
相同条件下,氢氧化钠的溶解度远大于氢氧化钙的溶解度;
(6)根据提供的数据及其反应的化学方程式可以计算判断相关方面的问题;
(7)若没有 A 装置,空气中的水蒸气会进入C装置中.
解答 解:(1)操作③的名称是过滤,提供过滤把液体和固体分离.
故填:过滤.
(2)上述流程中,加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
故填:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加硝酸和硝酸银的混合液,如果不产生白色沉淀,说明已经洗涤干净.
故选:B.
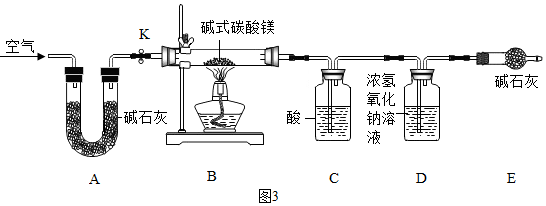
(4)实验中搅拌的目的是使反应物充分混合接触,提高反应速率;
水浴加热的优点是反应物受热均匀.
故填:使反应物充分混合接触,提高反应速率;反应物受热均匀.
(5)C 中的物质是浓硫酸,用来吸收水蒸气;
实验过程中,当关闭 K 后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中无气泡产生,则其已完全分解;
D处常用浓氢氧化钠溶液 而不用饱和石灰水的原因是等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳.
故填:浓硫酸;无气泡产生;等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳.
(6)设碱式碳酸镁中碳酸镁质量为x,生成氧化镁质量为y,
MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑
84 40 44
x y 1.76g
$\frac{84}{x}$=$\frac{40}{y}$=$\frac{44}{1.76g}$,
x=3.36g,y=1.6g,
设碱式碳酸镁中氢氧化镁质量为z,
碱式碳酸镁分解生成氧化镁质量为:2.00g-1.6g=0.4g,
Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,
58 40
z 0.4g
$\frac{58}{z}$=$\frac{40}{0.4g}$,
z=0.58g,
$\frac{3.36g}{84}$:$\frac{0.58g}{58}$=x:y,
x:y=4:1,
答:该碱式碳酸镁中 x:y 的最简整数比是4:1.
(7)若没有 A 装置,空气中的水蒸气会进入C装置中,则会导致反应生成的水偏大,从而导致测定得到的z值偏大.
故填:偏大.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 化学来源于生活、化学与生活密切相关.
化学来源于生活、化学与生活密切相关.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 使用酒精灯时不慎打翻着火,用湿抹布盖灭 | |
| B. | 患有胃溃疡的病人,不可服用含碳酸氢钠的胃药 | |
| C. | 厨房燃气管漏气,立即关闭阀门并打开排风扇通风 | |
| D. | 高楼着火,用湿毛巾捂住口鼻,蹲下并靠近地面撤离 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  燃烧硫磺熏蒸银耳 | B. |  工业酒精勾兑白酒 | ||
| C. |  淀粉、糖浆掺成假奶粉 | D. |  工业石蜡美容苹果 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SiO2中的Si的化合价为+4 | B. | 酒精是由碳、氢、氧三种元素组成 | ||
| C. | 该保鲜剂不能与明火接触 | D. | 酒精挥发时分子体积变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com