
【题目】2017年5月,中国科学家取得了将二氧化碳和氢气反应制取化工原料乙烯的重大突破。该化学反应的微观过程如下图所示。下列有关该化学变化的说法正确的是
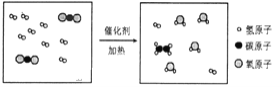
A. 生成物有3种物质
B. 从微观角度看,该化学变化改变的微粒是原子
C. 反应前后所有元素化合价都没有发生改变
D. 反应中各物质的化学计量数之和是13
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
【查阅资料】① 铜锈受热易分解 ② 硫酸铜粉末遇水由白色变为蓝色
【进行实验】 小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
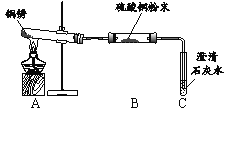
【解释与结论】(1)C中反应的化学方程式是______。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和______。
II.探究铜生锈的条件
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
【解释与结论】
(3)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是______。
(4)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是______(填编号)。
(5)对比实验②和③,得出的结论是______。
(6)为验证猜想,请在图中将实验⑤补充完整。______
(7)由上述实验可推知,铜生锈的条件是______。
【反思与应用】
(8)结合上述实验,你对保存铜制品的建议是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO2与NaOH能够发生反应,某同学按下图组装实验装置,并进行实验。
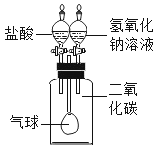
(1)有时药品滴加顺序会影响实验现象。如果观察到的现象是气球先膨胀,后变瘪”,则加入试剂的顺序应该是_______________(填序号)
A.先加入盐酸,再加入氢氧化钠溶液
B.先加入氢氧化钠溶液,再加入盐酸
(2)请解释气球“先膨胀”的原因___________________________________________,写出气球“后变瘪”的化学方程式______________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是
A. 向一定量铁粉中滴加稀盐酸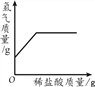
B. 向一定量CaCO3中加入稀盐酸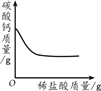
C. 加热一定量高锰酸钾固体 
D. 向盛有MnO2的烧杯中加入H2O2溶液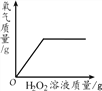
查看答案和解析>>
科目:初中化学 来源: 题型:
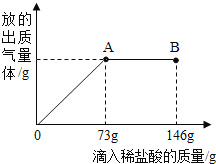
【题目】已知Na2CO3的水溶液呈碱性,在一烧杯中盛有20.4g Na2CO3和 NaCl 组成的固体混合物.向其中逐渐滴加溶质质分数为 10%的稀盐酸.放出气体的总 质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中 B 点时,烧杯中溶液的 pH______7(填>、=、<).
(2)当滴加稀盐酸至图中 A 点时,烧杯中为不饱和溶液(常温),通过计算求出 其中溶质的质量分数___________.(计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,以下说法正确的是
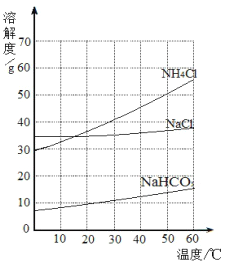
①在20℃时,三种物质的溶液溶质质量分数为NH4Cl>NaCI>NaHCO3
②在20℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
③等质量的三种物质的饱和溶液从40℃降温到0℃,所得溶液溶质质量分数为NH4CI>NaCI>NaNCO3
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度控制在10℃以下
A. ①②③ B. ①③④ C. ①③ D. ②④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钇(Y)是一种稀土元素,该元素在元素周期表中的信息如图所示。下列有关说法错误的是( )
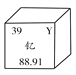
A. 钇属于金属元素
B. 钇原子中的质子数为39
C. 钇元素的相对原子质量为88.91
D. 钇原子中的中子数为39
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小华同学在复习酸碱盐知识时整理了如下网络图,“→”表示相互转化,“—”相互反应。已知A、B、C、D是初中化学常见的物质,为金属单质、金属氧化物、碱和盐中的各一种,下列说法不正确的是
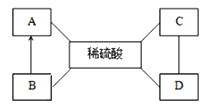
A. 如果A是铁,则A与稀硫酸反应产生气泡,溶液变成浅绿色
B. 如果B是金属氧化物,B转化为A可能是工业炼铁的原理
C. 如果C溶液呈碱性,则D只能是盐
D. 如果D与稀硫酸反应产生二氧化碳,则C只能是碱
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、 船舶及化学工业中已大量应用。工业经济的飞速发展,对铝合金的需求日益增多,使铝合金的研究也随之深入。已知某铝合金粉末除铝外,还含有铁、铜中的一种或两种。某兴趣小组在老师的指导下,对铝合金粉末中铁、铜的存在情况进行了探究。
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水); Fe、Cu不与氢氧化钠溶液反应。
猜想1:该合金粉末中除铝外,还含有铁。
猜想2:该合金粉末中除铝外,还含有铜。
猜想3:该合金粉末中除铝外,还含有铁、铜。
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液。
实验方案 | 实现现象 | 结论 |
①取一定量的合金粉末,加过量的___________,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有________ 。 |
②取步骤①所得滤渣,加过量的___________,充分反应。 | 滤渣部分溶解,并有气体放出,溶液呈浅绿色。 | 合金中一定含有_________。 |
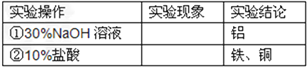
【探究结论】猜想 _________成立。
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与稀盐酸反应的化学方程式 ___________________。
【拓展与分析】
为了验证铝、铁的金属活动性强弱,小刘同学设计了如下实验方案:把表面积相同的铝丝和铁片同时投入到相同体积的稀盐酸中,比较反应的剧烈程度。请你评价该方案在操作过程中和控制变量上的不足之处。
操作过程中的不足之处___________________。
控制变量上的不足之处________________________。
请你再设计一种不同类型的实验方案,验证铝、铁的金属活动性强弱。________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com