
科目:初中化学 来源: 题型:
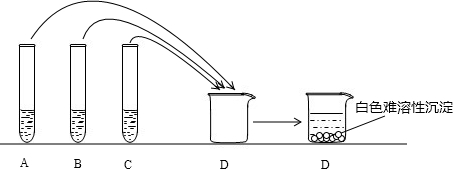
| 猜想 | 实验操作 | 现象 | 结论 |
可能是硫酸钠 可能是硫酸钠 |
取样品滴加紫色石蕊试液 取样品滴加紫色石蕊试液 |
若紫色石蕊溶液不变色 若紫色石蕊溶液不变色 |
证明是硫酸钠 证明是硫酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如下图所示进行实验.仪器a的名称是__________,C中用于加热仪器的名称是_________.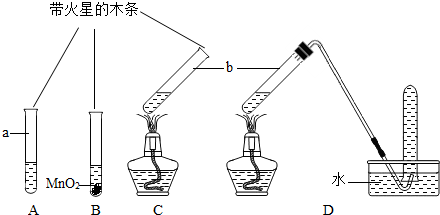 |
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. |
| 分析 | B试管中发生反应的化学方程式是______________. 实验结束后仪器b中的液体质量都减少,原因是_____________________ ________________________________________________________________. |
| 结论 | ①分析A、B实验可以得出的结论是:______________________________. ②加热__________(填“能”或“不能”)促进过氧化氢分解产生氢气. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如图所示进行实验.仪器a的名称是 试管 试管 ,C中用于加热仪器的名称是酒精灯 酒精灯  | ||||
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. | ||||
| 分析 | B试管中发生反应的文字表达式 过氧化氢
过氧化氢 .
实验结束后仪器b中的液体质量都减少,原因是 反应生成了氧气逸出 反应生成了氧气逸出 加热反应的过程中有水蒸气逸出 加热反应的过程中有水蒸气逸出 | ||||
| 结论 | ①分析A、B实验可以得出的结论是: 二氧化锰可以加快过氧化氢的分解 二氧化锰可以加快过氧化氢的分解 .②加热 能 能 (填“能”或“不能”)促进过氧化氢分解产生氢气. |
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰( MnO2 )粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 170 | 80 | 70 | 50 | 40 | 30 | 20 | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤(夹持固定装置已略去) | A、B、C三支试管中分别盛有等体积5%的过氧化氢溶液,如下图所示进行实验.仪器a的名称是__________,C中用于加热仪器的名称是_________.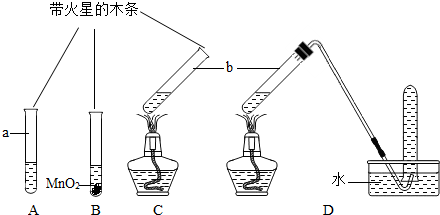 |
| 实验现象 | A:试管壁有气泡附着,带火星的木条不复燃. B:有大量气泡产生,带火星的木条复燃. C:有大量气泡产生,带火星的木条不复燃. D:有大量气泡产生,用带火星的木条检验收集的气体,木条复燃. |
| 分析 | B试管中发生反应的化学方程式是______________. 实验结束后仪器b中的液体质量都减少,原因是_____________________ ________________________________________________________________. |
| 结论 | ①分析A、B实验可以得出的结论是:______________________________. ②加热__________(填“能”或“不能”)促进过氧化氢分解产生氢气. |
查看答案和解析>>
科目:初中化学 来源:2012年11月中考化学模拟试卷(4)(解析版) 题型:解答题
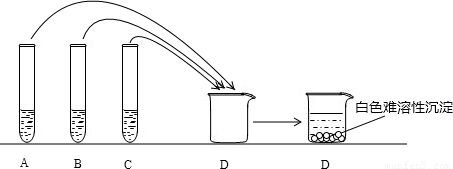
| 猜想 | 实验操作 | 现象 | 结论 |
| ______ | ______ | ______ | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com