兴衡中学校办工厂生产氢氧化钠的反应原理为:Ca(0H)2+Na2CO3═CaCO3↓+2NaOH,其产品中含有少量的碳酸钠.在产品出厂前都要检验氢氧化钠的纯度,看是否达到生产要求.在某次检验中,技术员取样l00g,加入足量水溶解后,滴加氯化钡(BaCl2)溶液21.6g时,恰好反应完全,经过滤、洗涤、干燥后得到碳酸钡(BaCO3)固体3.94g.
试求:
(1)该产品中氢氧化钠的纯度(假设产品中的杂质只有碳酸钠)(最后结果准确到0.01%).
(2)反应前氯化钡溶液中溶质的质量分数.
【答案】
分析:利用化学方程式根据生成的碳酸钡3.94g求出碳酸钠和氯化钡的质量,然后求出氢氧化钠的质量100-2.12=97.88g,氢氧化钠的质量比上样品的质量即是氢氧化钠的纯度;用氯化钡的质量比上氯化钡溶液的质量即是应前氯化钡溶液中溶质的质量分数.
解答:解:设l00 g样品中的Na
2CO
3的质量为x;反应的BaCl
2的质量为y.
BaCl
2+Na
2CO
3═BaCO
3↓+2NaCl
208 106 197
y x 3.94 g
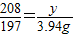
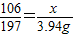
x=2.12g
y=4.16 g
(1)NaOH的纯度为:
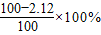
=97.88%
(2)BaCl
2溶液中溶质的质量分数
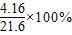
=l9.26%
答:该批产品的纯度为97.88%;原氯化钡溶液中溶质的质量分数为19.26%.
点评:本题考查了利用化学方程式具体的计算步骤,属于基础知识,难度不大,关键注意解题格式.

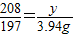
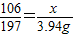
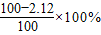 =97.88%
=97.88% 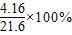 =l9.26%
=l9.26%

 阅读快车系列答案
阅读快车系列答案