
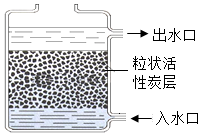
 如图所示是一净水器,其中的活性炭具有较强的吸附性,它可以吸附水中的一些可溶性的杂质,并除去异味,粒状的活性炭层还能起到过滤的作用,滤去自然水中的不溶性性杂质.
如图所示是一净水器,其中的活性炭具有较强的吸附性,它可以吸附水中的一些可溶性的杂质,并除去异味,粒状的活性炭层还能起到过滤的作用,滤去自然水中的不溶性性杂质.  99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
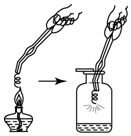 科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:
科学探究是重要的学习方式,假设和验证是探究过程中的重要环节.为了探究“铁丝可以在纯净的氧气中燃烧”,同学们将一根火柴梗塞入一段螺旋状“铁丝”(可能是纯铁丝或含碳铁丝)末端,将它固定,用镊子夹住“铁丝”,然后将火柴在酒精灯上点燃,将“铁丝”由集气瓶口向下慢慢伸入,观察现象:| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出耀 眼白光,无火星 | 剧烈燃烧,极少火星 | 剧烈燃烧,少量火星 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com