
| 步骤 | 实验操作 | 预期现象和结论 |
| 1 | 各取2mL反应后的混合溶液分别加入A、B两只试管中 | 多余空 |
2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | 有气泡产生,品红溶液褪色,证明含有Na2SO3 |
3 | 向B试管中,加入足量的氯化钡溶液溶液,再加入足量的稀盐酸 | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有Na2SO4,则猜想3成立 |
分析 (1)考虑酸雨的概念.
(2)书写化学方程式时要注意配平;
(3)亚硫酸钠和稀盐酸反应能生成氯化钠、水和二氧化硫;
【进行猜想】
亚硫酸和氢氧化钠反应能生成亚硫酸钠和水,稀硫酸和氢氧化钠反应能生成硫酸钠和水;
[实验探究]
亚硫酸钠和稀硫酸反应能生成硫酸钠、水和二氧化硫,二氧化硫能使品红溶液褪色;
氯化钡能和硫酸钠反应生成硫酸钡沉淀和氯化钠,硫酸钡不溶于稀盐酸;氯化钡能和亚硫酸钠反应生成亚硫酸钡沉淀和氯化钠,亚硫酸钡溶于稀盐酸,能和稀盐酸反应生成氯化钡、水和二氧化硫.
解答 解:(1)酸雨是pH小于5.6的降雨;
(2)高温条件下,氧化钙和二氧化硫、氧气反应能生成硫酸钙,反应的化学方程式为:2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4.
故填:2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4.
(3)亚硫酸钠和稀盐酸反应能生成氯化钠、水和二氧化硫,反应的化学方程式为Na2SO3+2HCl═2NaCl+H2O+SO2↑.
故填:Na2SO3+2HCl═2NaCl+H2O+SO2↑.
【进行猜想】
如果酸雨中只含有亚硫酸,则盐是亚硫酸钠,如果酸雨中只含有硫酸,盐是硫酸钠,如果酸雨中含有亚硫酸和硫酸,则盐是亚硫酸钠和硫酸钠.
故填:只有Na2SO4.
【实验探究】
2、如果溶液中含有亚硫酸钠,向A试管中滴加足量的稀硫酸时,稀硫酸中和完过量的氢氧化钠后,和亚硫酸钠反应生成硫酸钠、水和二氧化硫,二氧化硫能使品红溶液褪色,观察到的实验现象是:有气泡产生,品红溶液褪色.
故填:有气泡产生,品红溶液褪色.
3、向B试管中,加入足量的氯化钡溶液,再加入足量的稀盐酸,如果先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有亚硫酸钠和硫酸钠,因为加入足量的氯化钡溶液后,亚硫酸钠和氯化钡反应生成亚硫酸钡沉淀和氯化钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,再加入足量的稀盐酸时,中和完氢氧化钠后,稀盐酸能和亚硫酸钡反应生成硝酸钡、水和二氧化硫,硫酸钡不能和稀盐酸反应.
故填:足量的氯化钡溶液;稀盐酸.
故答案为:
(1)5.6.
(2)2CaO+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4
(3)Na2SO3+2HCl═2NaCl+H2O+SO2↑
(4)
[进行猜想]猜想2:只有Na2SO4
[实验探究]
| 步骤 | 实验操作 | 预期现象和结论 |
| 1 | ||
2 | 有气泡产生,品红溶液褪色, | |
3 | 足量的氯化钡溶液 |
点评 实验现象是反应的外在表现,通过实验现象可以判断化学反应的实质,要学会观察、分析实验现象,只有这样才能对问题作出正确的解答.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 沼气和天然气都是不可再生的优质能源 | |
| B. | 图书、档案着火,用水基型灭火器灭火 | |
| C. | 发现家里的燃气泄漏,立即打电话报警 | |
| D. | 淡水资源约占全球水储量的2.53% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO(CO2)-通过灼热的CuO粉末 | |
| B. | NaCl(Na2SO4)-加入适量的Ba(NO3)2溶液 | |
| C. | CaO固体(CaCO3固体)-加足量水后过滤 | |
| D. | FeSO4溶液(H2SO4)-加入适量铁粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ④ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NH4Cl | B. | Ca3(PO4)2 | C. | K2CO3 | D. | KNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
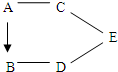 A、B、C、D、E为初中化学中不同类别的物质,它们的变化关系如图所示,其中棕红色物质A在一定条件下可以转化为单质B,“-”表示相连的两种物质能发生反应,“→”表示相连的两种物质能转化.则:
A、B、C、D、E为初中化学中不同类别的物质,它们的变化关系如图所示,其中棕红色物质A在一定条件下可以转化为单质B,“-”表示相连的两种物质能发生反应,“→”表示相连的两种物质能转化.则:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
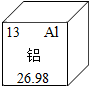 铝元素与人类关系密切
铝元素与人类关系密切查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com