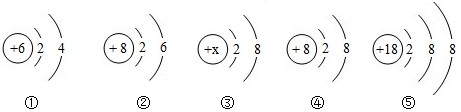
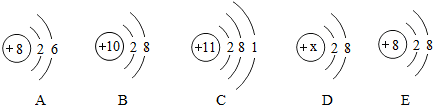
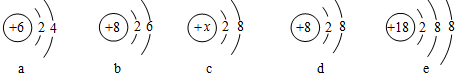分析:(1)根据不同种元素最本质的区别是质子数不同,进行分析解答;若原子的最外层电子数为8,则为稀有气体元素,属于相对稳定结构;若原子的最外层电子数<4,则一般为金属元素,在化学反应中易失去电子.
(2)根据决定元素化学性质的是原子的最外层电子数进行分析解答.
(3)根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.
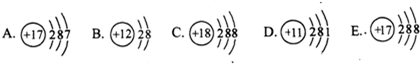
解答:解:(1)根据不同种元素最本质的区别是质子数不同,图中粒子的核内质子数分别为17、12、18、11、9,共表示5种元素.C质子数=核外电子数=18,为原子,且最外层电子数为8,则为稀有气体元素.D质子数=核外电子数=11,为原子,且最外层电子数是1,小于4,为金属元素.
(2)决定元素化学性质的是原子的最外层电子数,A粒子最外层电子数为7,E粒子的最外层电子数为7,两者的化学性质相似.
(3)B质子数=12,核外电子数=10,质子数>核外电子数,为镁离子,其离子符号为Mg2+;E质子数=17,核外电子数=18,质子数<核外电子数,为氯离子,其离子符号为Cl-;二者形成的化合物为氯化镁,其化学式为MgCl2.
故答案为:(1)5;C;D;(2)E;最外层电子数相同;(3)Mg2+;Cl-;MgCl2.
点评:本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.

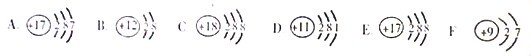


 化学用语可准确、简洁地记录、表达和交流化学信息.
化学用语可准确、简洁地记录、表达和交流化学信息.