今有氢氧化钠、碳酸氢钙和其它物质都不反应,受热也不分解的杂质组成的固体混合物共12克,放入密闭的容器内加热,经充分反应后,将容器中的气体通入澄清石灰水中得到白色沉淀2.5克,当容器内的残留固体冷却至室温后,向固体中加水至固体质量不再减少为止,过滤,向所得溶液中加入10克18.25%的盐酸溶液恰好为中性.求原混合物中杂质的质量分数.
解:设与石灰水反应的二氧化碳质量为X
1,与氢氧化钠反应的二氧化碳的质量为X
2,与盐酸反应碳酸钠的质量为Y,氢氧化钠的质量为Z,碳酸氢钙质量为M根据反应
Ca(OH)
2+CO
2=CaCO
3↓+H
2O
44 100
X
1 2.5克
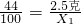
,
解得X
1=1.1克,
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 73
Y 10克×18.25%

,
解得Y=2.65克,
2NaOH+CO
2=Na
2CO
3+H
2O
80 44 106
Z X
2 2.65克
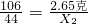
,
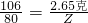
,
解得X
2=1.1克,Z=2.0克,
Ca(HCO
3)
2
CaCO
3+H
2O+CO
2↑
162 44
M (1.1克+1.1克)
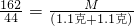
,
解得M=8.1克,
因杂质不与其它物质反应,受热也不分解,
则杂质质量为12克-8.1克-2.0克=1.9克,
杂质的质量分数为
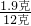
×100%=15.8%,
答:原混合物中杂质的质量分数为15.8%.
分析:根据混合物受热分解生成的气体通入澄清石灰水中得到白色沉淀,利用沉淀质量可计算二氧化碳的质量,再利用固体溶于水过滤后的滤液加入10克18.25%的盐酸溶液恰好为中性来计算氢氧化钠与二氧化碳反应生成的碳酸钠的质量,则可求出进一步计算出二氧化碳的质量,将二氧化碳的总质量代入碳酸氢钙分解的化学反应方程式来计算计算碳酸氢钙的质量,最后计算杂质的质量分数.
点评:本题较难,考查学生利用化学反应方程式的计算,明确在加热时发生的化学反应是解答的关键,正确将二氧化碳的质量求出代入碳酸氢钙分解的反应是解答的难点.

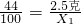 ,
, ,
,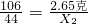 ,
,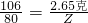 ,
, CaCO3+H2O+CO2↑
CaCO3+H2O+CO2↑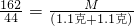 ,
,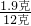 ×100%=15.8%,
×100%=15.8%,
