
【题目】化学是一门以实验为基础的科学,实验是学习化学的一条重要途径。根据以下实验解答下列问题。
(1)下图是测定空气中氧气含量的实验装置。实验中能得出“氧气约占空气总体积五分之一”结论的实验现象是________。
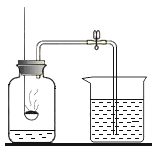
(2)若装置的气密性良好,去掉烧杯,点燃红磷,在装置完全冷却后。打开弹簧夹,装置的总质量会______(填“增加”、“减少”或“不变”)原因是_______。
(3)小明同学在学习完空气成分测定实验后改进了课本上的装置图如图(查阅资料得出白磷红磷一样有可燃性,且燃烧后的生成物也相同,但白磷在40℃即可燃烧)。回答下列问题:
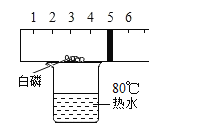
①写出白磷燃烧的文字表达式_________,实验时,可以观察到活塞先向______移动(填“左”或“右”),后移动到刻度______处。
②小张同学重复小明同学的实验,但是结果活塞只移动到刻度4.5处,可能是什么原因____。
③改进后的实验装置的优点是_________。
【答案】冷却后,打开止水夹,进入烧杯中的水的体积约占集气瓶剩余气体体积的五分之一 增加 打开弹簧夹后空气进入瓶中,补充消耗的氧气 ![]() 右 4 装置漏气(合理即可) 环保(合理即可)
右 4 装置漏气(合理即可) 环保(合理即可)
【解析】
(1)实验中能得出“氧气约占空气总体积五分之一”结论的实验现象是冷却后,打开止水夹,进入烧杯中的水的体积约占集气瓶剩余气体体积的![]() ;
;
(2)若装置的气密性良好,去掉烧杯,点燃红磷,在装置完全冷却后,压强减小,打开弹簧夹,空气会进入,补充消耗的氧气,装置的总质量会增加;
(3)①磷与氧气在点燃的条件下反应生成五氧化二磷,文字表达式为![]() ;由于燃烧放热,所以活塞先向右移动;当白磷熄灭后,由于消耗了装置内空气体积的五分之一,所以最后活塞停留在刻度4处;
;由于燃烧放热,所以活塞先向右移动;当白磷熄灭后,由于消耗了装置内空气体积的五分之一,所以最后活塞停留在刻度4处;
②若装置漏气或白磷的量不足、或没有冷却至室温就打开止水夹;
③该装置始终是密封的,所以测定所得数据比较准确,而且环保;


科目:初中化学 来源: 题型:
【题目】某兴趣小组同学利用如图装置进行相关实验
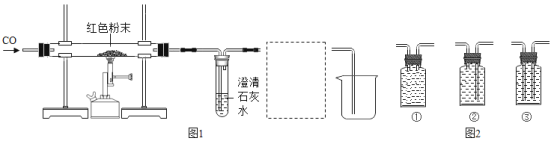
(实验1)模拟炼铁实验
(1)若样品为氧化铁,则A中的实验现象是___________,反应的化学方程式是_____,B中反应的化学方程式是_________。
(2)实验时要先通CO再加热的目的是___________。
(3)图1虚线框内的装置用于吸收CO2并收集CO,从图2(瓶内均为氢氧化钠溶液)中选择最合适的装置为___________(填序号)。
(实验2)测定样品的组成
若样品有氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,带充分反应后,实验数据记录如下:
样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
2.32g | 反应前55.72g | 反应前281.00g |
反应后55.08g | 反应后281.56g |
样品中铁元素和氧元素的质量比为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图像中,不能正确表示对应变化关系的是( )
A.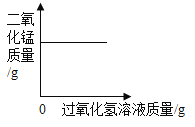 向一定量的二氧化锰中加入过氧化氢溶液
向一定量的二氧化锰中加入过氧化氢溶液
B.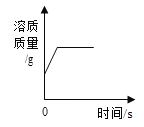 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
C.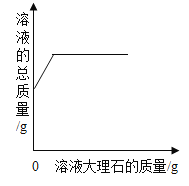 向一定量的稀盐酸中加入大理石
向一定量的稀盐酸中加入大理石
D.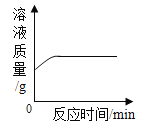 向一定量的硝酸银溶液中插入铜丝
向一定量的硝酸银溶液中插入铜丝
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能反映相关实验过程中量的变化的图像是
A.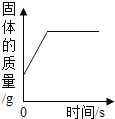 用一氧化碳还原氧化铁
用一氧化碳还原氧化铁
B.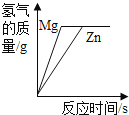 等质量镁、锌分别和过量等浓度的盐酸反应
等质量镁、锌分别和过量等浓度的盐酸反应
C.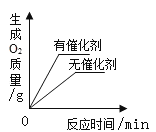 用等质量、等质量分数的双氧水制取氧气
用等质量、等质量分数的双氧水制取氧气
D.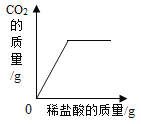 向一定质量的大理石(杂质不参加反应)中滴加稀盐酸
向一定质量的大理石(杂质不参加反应)中滴加稀盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~ F为六种不同物质,其中A、D是组成元素及状态相同的物质,C转化为B可通过绿色植物光合作用完成; E与B反应可能生成C或F。(“→"表示由某一种物质转化为另一种物质,“一 ”表示相连两种物质之间能发生反应,部分反应物、生成物及反应条件已略去)。
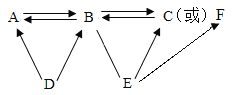
(1)物质D的名称是_________________________。
(2) B→A的化学方程式是_________________________。属于化学基本反应类型中的___________反应。
(3)上述六种物质中,属于氧化物的是________________(填化学式)。
(4)参考如图,在(__________)内画出“→”或“一”补全图例(“→”表示物质间转化,“一”表示物质间相互反应)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列2个实验是人教版九年级化学中的演示实验,请回答。

(1)A实验中,导致实验结果偏小的原因可能是_____(写一点);如果用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因是_____。
(2)B实验中,铜片上的白磷燃烧而红磷不燃烧,说明燃烧的条件之一是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)写出下列符号或示意图中数字“2”的含义
2H:_______ ;Mg2+_________
(2)地壳中含量最高的金属与空气中含量排第二位的物质反应的生成物化学式为______,苏打(碳酸钠)的化学式为_________
(3)硝酸(HNO3)是高中化学将要学习的一种常见物质,硝酸中氮元素的化合价为______价,浓硝酸见光会发生分解反应,生成红棕色的NO2气体和一种常见液体以及能供给呼吸的气体,写出该反应的化学方程式_________
(4)甲、乙、丙是初中化学常见的三种物质,其相互转化关系如图,通常甲为固态单质,乙、丙为两种气体,且所含元素种类相同,乙易与血液中的血红蛋白结合。
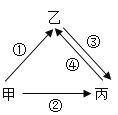
写出③、④转化的化学方程式:③_________;④_________
(5)在天平(灵敏度极高)两边的烧杯中分别盛有等质量的足量的稀硫酸,天平平衡,再向两烧杯中分别加入相同质量的镁(左盘)和铁(右盘),充分反应后,天平______,(填平衡或不平衡)。如果不平衡,指针偏向______(填左或右)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:
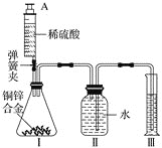
①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
【答案】(1)![]() ;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
【解析】
试题(1)由于铜排在了氢的后面,所以与酸不反应,反应物是锌和硫酸,生成物是硫酸锌和氢气,氢气后面标上上升符号;实验过程中须加入稀硫酸至不再产生气体,目的是使样品中的锌完全反应;(2)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到带有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(3)根据加入稀硫酸的量进行计算需要知道稀硫酸的溶质质量分数,而题中没有告知;(4)由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根据热涨冷缩的原理可知进入量筒中水偏多,所以误认为得到的氢气多,再就是数据处理时,未排除加入稀硫酸所占的体积,计算的结果就偏大;
考点:金属的化学性质;化学方程式;实验误差分析;
点评:熟记金属活动性顺序表,知道排在氢之前的金属和稀盐酸或者硫酸反应生成氢气,而排中氢之后的金属和稀盐酸或者稀硫酸不生成氢气;化学反应中物质的质量比都是纯净物之间的质量比,而溶液中溶质的质量=溶液质量×溶质质量分数;本题容易出错的地方是对实验结果的评价,要知道锌与硫酸反应放出热量,会造成相应的误差,必须冷却到室温才能进行观察和计算。
【题型】实验题
【结束】
30
【题目】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们利用如图所示装置进行气体的制备实验。
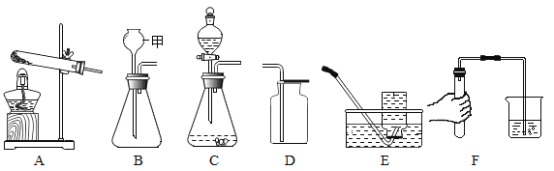
(1)写出图B装置中甲仪器的名称___________;
(2)用过氧化氢溶液和二氧化锰的混合物制取氧气,化学方程式为________。收集氧气可以选择______(填装置编号);
(3)实验室制取CO2通常选择下列药品中的_____(填字母选项);
A 稀盐酸 B 熟石灰 C 块状石灰石 D 稀硫酸
通常检验CO2气体的反应可用化学方程式表示为________;
(4)常温下,可用固体硫化亚铁(FeS)和稀硫酸反应制取硫化氢(H2S)气体,若要控制滴加液体的速率,可选择的发生装置是_____(填装置编号)。
(5)描述F装置中的实验现象及结论______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com