
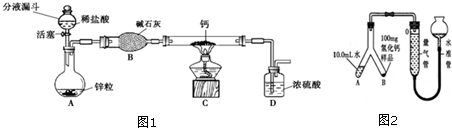
分析 【氢化钙的制备】
(1)根据盐酸和锌反应生成氯化锌和氢气进行解答;
(2)根据碱石灰的吸水性考虑;
(3)根据氢气与钙反应生成氢化钙考虑;
(4)根据检查装置气密性的方法和题目要求分析解答.
【产品的定量测定】
(5)根据装置特点和氢化钙与水反应生成氢气进行分析;
(6)氢气的体积等于反应前后液面差;
(7)依据氢气的质量=氢气的体积×氢气的密度求出氢气的质量,再结合氢化钙与水反应方程式及钙与水反应方程式,求出氢化钙的质量,进而计算样品中氢化钙的纯度.
解答 解:【氢化钙的制备】
(1)锌与稀盐酸能反应生成氯化锌和氢气,化学方程式为Zn+2HCl═ZnCl2+H2↑;(2)碱石灰能与盐酸反应,也能与水反应,所以碱石灰作用是吸收水蒸气和氯化氢气体;
(3)氢气与钙反应生成氢化钙,化学方程式为Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)要检查该套装置的气密性,可以将活塞关闭后,往分液漏斗中加入适量的水,然后用手指堵住装置D的导管口,打开活塞,观察分液漏斗内的液面变化判断装置是否漏气;
【产品的定量测定】
(5)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(6)氢气的体积等于反应前后液面差,为:110.0mL-10.0mL=100.0mL;
(6)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg;
设样品中氢化钙的质量是X,生成氢气质量为Y,则钙的质量为100mg-X,钙与水反应生成氢气质量为9mg-Y则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
$\frac{42}{4}=\frac{X}{Y}$ 解得Y=$\frac{2X}{21}$
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-X 9mg-Y
根据:$\frac{40}{2}=\frac{100mg}{9mg-Y}$ 将Y=$\frac{2X}{21}$代入,解得X=88.4mg
所以样品中氢化钙的纯度为:$\frac{88.4mg}{100mg}$×100%=88.4%;
故答案为:(1)Zn+2HCl=ZnCl2+H2↑;(2)吸收水蒸气和部分氯化氢气体;(3)Ca+H2 $\frac{\underline{\;\;△\;\;}}{\;}$CaH2;(4)将活塞关闭后,往分液漏斗中加入适量的水,用手指堵住装置D的导管口,打开活塞,若气密性良好,可观察到分液漏斗内的液面几乎不下降(合理答案均可).(5)观察右边的量气管中液面,若不再变化,则已完全反应;(6)100.0;(4)88.4%.
点评 本题考查了化学反应方程式的书写以及有关物质的用途,完成此题,可以依据已有的知识结合提供的信息进行.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:初中化学 来源: 题型:选择题

| A. | 甲物质的溶解度一定大于乙物质的溶解度 | |
| B. | 将甲溶液从t2℃降温到t1℃时,一定有晶体析出 | |
| C. | t2℃时,甲、乙饱和溶液的溶质质量分数相等 | |
| D. | 将t2℃时乙的饱和溶液变为不饱和溶液,可采用降温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
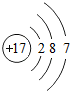 如图是元素X的原子结构示意图.下列说法正确的是( )
如图是元素X的原子结构示意图.下列说法正确的是( )| A. | X属于金属元素 | |
| B. | 该原子核外电子数为7 | |
| C. | 该原子形成的离子可表示为X- | |
| D. | 该原子形成的离子,核外有两个电子层 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 两种干燥剂袋上都要有明显的“勿食”字样 | |
| B. | 铁粉干燥剂能与水和氧气发生化合反应 | |
| C. | CaO干燥剂吸水的过程是化学变化 | |
| D. | CaO干燥剂在空气中失效后的最终产物为Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com