
粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如下图所示:
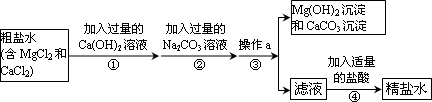
(1)Ca(OH)2溶液的pH________(填“>”、“=”或“<”)7.步骤①反应的化学方程式为________.
(2)步骤③操作a的名称是________.步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和________.
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有________.
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 蒸发皿的质量 | 蒸发皿的质量+ 食盐溶液的质量 |
蒸发皿的质量+ 食盐晶体的质量 |
| 28.8g | 48.8g | 30.7g |
查看答案和解析>>
科目:初中化学 来源: 题型:
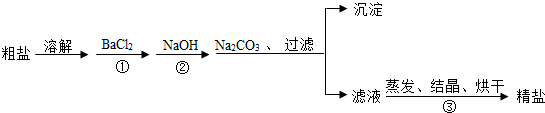
查看答案和解析>>
科目:初中化学 来源: 题型:
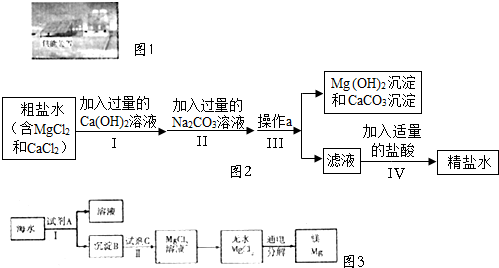
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com