
 =
=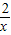
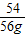 =
=
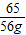 =
=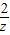


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:初中化学 来源: 题型:
| 物质名称 | 氯化铝 | 氯化铁 | 氯化铜 |
| 水溶液颜色 | 无色 | 黄色 | 蓝绿色 |
| 实验组别 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 药品 | 金属单质 | Al | Mg | Zn | Fe | Zn | Al | Cu |
| 氧化物 | CuO | CuO | CuO | CuO | Fe2O3 | Fe2O3 | Fe2O3 | |
| 实验现象 | 取上述粉末状的混合物于密闭试管中高温加热 | 爆炸 | 爆炸 | 变红 | 变红 | 变黑 | 变黑 | 无变化 |
| 冷却后,向上述反应后的固体中加入足量的稀盐酸 | -- | -- | 固体部分溶解,水溶液呈无色 | 固体部分溶解,水溶液呈黄色 | 固体全部溶解,有气体放出,水溶液呈浅绿色 | ? | -- | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com