3.阅读下列文字,解决后面的问题.--厨房中的化学知识
厨房里有各种各样的锅:煮饭锅、炒菜锅、蒸锅、高压锅、平底锅等等.从制造的原料来看,一般只有铁锅和铝锅两种.
由于人类发现和使用铜比铁早得多,所以古代人用铜锅烧水做饭.铜有光泽,比铁美观,传热能力强.但是,用铜做炊具,易产生有毒的锈--铜绿,还会破坏食物中的维生素C,且价格较贵.后来,铁锅就取代了铜锅.铁有钢和生铁之分,其主要区别在于含碳量不同.生铁含碳量超过1.7%,钢含碳量在0.2%以下.生铁又硬又脆,钢软而有韧性.钢可以做炒菜锅和铁勺.铁锅具有价格便宜、可预防缺铁性贫血等优点,但也有笨重、易锈、传热性差等缺点.
现在厨房里的用具很多是铝或铝合金制品,锅、壶、铲、勺几乎全是铝质的.和铁相比,铝的传热本领强,既轻盈又美观.因此,铝是制炊具的理想材料.有人以为铝不生锈.其实,铝是活泼的金属,它很容易和空气里的氧化合,生成一层透明的、薄薄的铝锈--三氧化二铝(Al
2O
3).不过,这层铝锈和疏松的铁锈不同.它十分致密,好象皮肤一样保护内部不再被锈蚀.可是,这层铝锈薄膜既怕酸,又怕碱.
因为铝盐有神经性毒性,所以使用铝锅时需小心.在铝锅里存放菜肴的时间不宜过长,不要用来盛放醋、酸梅汤、碱水和盐水等.若用铝锅煮茶水会溶出较多的铝,原因是由于茶中含有较多的氟,易与铝形成可溶性的氟铝配合物.正常自来水中含氟量大约是1毫克/升,往这种自来水中加柠檬酸调成pH=3的水溶液在铝锅中煮沸10分钟,即溶出200毫克/升的铝,为无氟时的1000倍.西红柿中的维C、糖醋鱼中的醋都呈酸性,均会加重铝的溶出,所以不宜用铝锅来烹制.
铝合金是在纯铝里掺进少量的镁、锰、铜等金属冶炼而成的,抗腐蚀本领和硬度都比纯铝高.用铝合金制造的高压锅、水壶,质量比纯铝制品好.近年来,商店里又出现了电化铝制品.这是铝经过电极氧化,加厚了表面的保护层(铝锈Al
2O
3),同时形成疏松多孔的附着层,可以牢牢地吸附住染料.因此,这种铝制的饭盒、饭锅、水壶等表面可以染上鲜艳的色彩,使铝制品更加美观,惹人喜爱.
家庭使用的燃料有多种,有固体的、液体的或是气体的.其共同点是它们都是碳或碳氢化合物.
人类最早使用的燃料是木柴.在国外,有些科学家呼吁发展“绿色能源“,建议多种可以当柴烧的“树木“.木柴中约有一半是纤维素.纤维素是由碳、氢、氧三种元素组成的化合物,其中碳元素占了近一半.
煤是由古代的植物变来的.燃烧1千克无烟煤可以获得30000多千焦的热量,是1千克木柴发的热量的2倍多.不过,由于煤是重要的化工原料,所以用煤做燃料是很大的浪费.况且,烧煤做饭,热量四散,燃料的有效利用率很低.将煤“干馏“就可得到煤气,同时又得到了焦炭、煤焦油和氨气.
煤气的主要成分是一氧化碳和甲烷.用煤气做燃料既方便又安全.在农村,可使用沼气或天然气(主要成分是甲烷).沼气的原料是粪便、秸秆和杂草,经过发酵得到了甲烷和肥料.现在大多数城市使用液化石油气,那是炼油厂的副产品----丙烷和丁烷的混合气.为了便于运输,人们把气体压缩成液体,贮存在结实的钢罐里.有的直接用管道输送到居民家的厨房,要用就开,要停就关,方便极了.
(1)调查厨房里各种各样的锅:煮饭锅、炒菜锅、蒸锅、高压锅、平底锅等等.从制造的原料来看,一般只有炒菜锅和平底锅两种,所用材料都属于金属材料(填“金属材料”或“合成材料”).
(2)天然气的主要成分是CH
4(填化学式),其燃烧所发生的化学反应方程式为CH
4+2O
2$\frac{\underline{\;点燃\;}}{\;}$CO
2+2H
2O,属于氧化反应(填“化合”“分解”“置换”“复分解”“氧化”之一).
(3)铝比铁活泼,但制品不容易生锈,其原因是铝能与空气中氧气反应在其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化.工业用电解氧化铝制铝,反应的化学方程式:2Al
2O
3$\frac{\underline{\;通电\;}}{\;}$4Al+3O
2↑.
(4)纤维素是由碳、氢、氧三种元素组成的化合物属于有机物(填“有机物”或“无机物”).
(5)合金的应用是人类社会文明发展的象征.有下列三种合金:①铁合金;②铝合金;③铜合金,这三种合金被广泛应用的先后顺序按年代由远及近排列应是③①②(填序号).
(6)欲探究铁、铝、铜的金属活动性顺序,将铁丝、铝丝和铜丝分别放入三支分别盛有稀盐酸、稀硫酸、稀醋酸的试管中,观察反应现象,分析并得出结论.请指出该实验设计的不合理之处并说明理由:酸的种类不同,无法通过各金属与不同酸反应的剧烈程度来确定金属的活动性
(7)某小组的同学还利用单质铜制取Cu(OH)
2,其设计方案如图1:
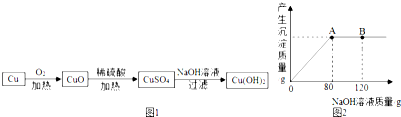
①铜在受热转化为CuO的过程中,观察到的现象是红色固体逐渐变成黑色.
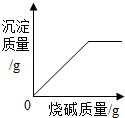
②取一定量的CuO放入盛有一定量稀硫酸的烧杯中,恰好完全反应.向烧杯中逐滴加入10%的NaOH溶液,产生沉淀的质量与所滴入NaOH溶液质量的关系曲线如图2所示,当滴入10%的NaOH溶液120g时(即B点),试通过计算,求,此时所得Cu(OH)
2沉淀的质量(计算结果)



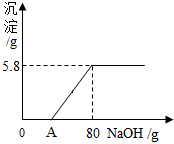 向盛有200g稀盐酸溶液的烧杯中加入一定量的铁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示,请回答:
向盛有200g稀盐酸溶液的烧杯中加入一定量的铁粉,固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示,请回答:
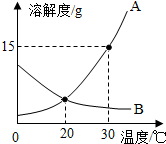 A、B两种固体物质的溶解度曲线如图所示.请回答:
A、B两种固体物质的溶解度曲线如图所示.请回答: