实验室中敞开盛有浓盐酸的试剂瓶,瓶口立即产生大量白雾;把盛有浓氨水的试剂瓶敞开,在瓶口却看不到白雾.同学们对氨气在空气中不能产生白雾的原因进行了如下探究:
[查阅资料]雾的形成条件有三:①有小液滴;②有空气;③小液滴在空气中分散必须十分密集,达到肉眼可见的程度.
[猜想]甲同学的猜想是:浓氨水的挥发性不强,瓶口附近空气中的氨气少,形成的氨水小液滴少,即小液滴分布不密集而不能产生雾.
乙同学的猜想是:氨气的扩散速率比氯化氢大,因此浓氨水挥发出来的氨气会快速向四周扩散,它与空气中水蒸气结合形成的氨水小液滴不能集中,即不可能形成雾.
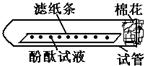
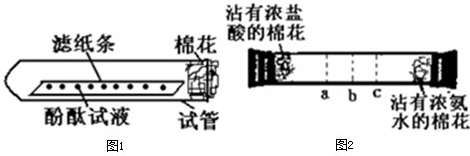
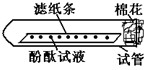
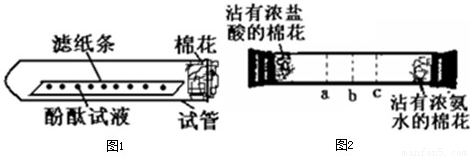
[实验论证]实验一:如下图所示,取一条长10cm、宽1cm的滤纸条,在滤纸条上每隔1、5cm-2cm处滴一小滴酚酞试液.滴好后把滤纸条放到试管里,在试管口塞上一小团棉花.然后用滴管吸取浓氨水,在试管口的棉花上滴10-15滴.
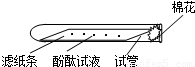
实验现象:______.
实验结论:浓氨水挥发出大量的氨气,且氨分子不断向周围扩散.所以甲同学的猜想不成立.
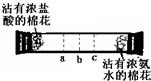
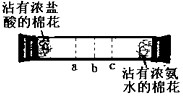
实验二:如下图所示,在一口径为2cm长50cm水平横放的中空玻璃管的两端,分别同时塞入沾有浓盐酸与浓氨水的棉花,立即用橡皮塞塞紧两端.
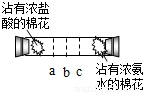
实验现象:数分钟后最有可能在试管中的______(选填a、b、c)处开始产生白烟.
白烟的成分是氯化铵(NH
4Cl),形成白烟的原因是(用化学方程式表示):______,反应类型为______.
实验结论:氯化氢分子、氨分子都能扩散,且扩散速率氨气比氯化氢大.所以乙的猜想成立.





 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案