56g10%的氢氧化钾溶液中加入一定量的稀硫酸,恰好完全反应后所得溶液质量为80.5g,计算所用稀硫酸的溶质质量分数.
【答案】
分析:根据氢氧化钾和稀硫酸恰好完全反应,由氢氧化钾的质量结合方程式可以计算出参加反应的硫酸溶质的质量,并据质量守恒定律计算出稀硫酸的质量,溶质的质量分数=

×100%分析解答.
解答:解:设所用稀硫酸溶质的质量为x
氢氧化钾质量=56 g×10%=5.6 g
H
2SO
4+2KOH═K
2SO
4+2H
2O
98 112
x 5.6 g
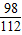
=
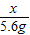
x=4.9g
稀硫酸溶液的质量=80.5 g-56 g=24.5 g
所用稀硫酸溶质的质量分数=
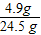
×100%=20%
答:所用稀硫酸溶质的质量分数为20%.
点评:本题能较好考查学生应用质量守恒定律、溶质的质量分数等分析和解决问题的能力,解答时要注意格式规范.

 ×100%分析解答.
×100%分析解答.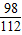 =
=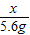
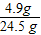 ×100%=20%
×100%=20% 
