
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
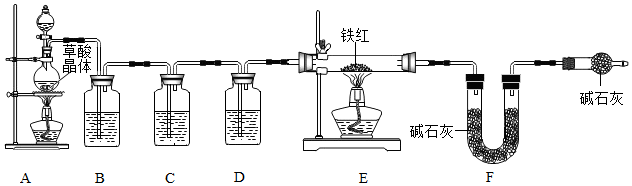
分析 【问题讨论】(1)根据气体的除杂与干燥方法来分析;
(2)根据二氧化碳的检验方法来分析;
(3)根据化学反应的原理以及化学方程式的写法来分析;
(4)根据极限法进行猜想以及质量守恒定律来分析解答;
【实验反思】(1)G装置中的碱石灰可以吸收空气中水和二氧化碳;
(2)尾气中含有有毒的一氧化碳.
解答 解:【问题讨论】(1)制取的气体中含有一氧化碳、二氧化碳和水蒸气,要得到纯净、干燥的CO,就需要先用氢氧化钠溶液除去其中的二氧化碳,然后用澄清的石灰水来检验二氧化碳是否完全除去,最后用浓硫酸进行干燥;故填:cba;
(2)二氧化碳能使澄清的石灰水变浑浊,所以装置C的作用是检验二氧化碳气体是否除尽;故填:检验二氧化碳气体是否除尽;
(3)在高温的条件下,一氧化碳能将铁的氧化物还原为铁,同时生成二氧化碳,故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(或4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2或CO+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2);
(4)①根据铁红中三种铁的氧化物的含铁量可知,氧化铁中铁元素的质量分数最小,氧化亚铁中铁元素的质量分数最大.则假设铁红中完全为氧化铁,则E中充分反应后得到铁粉的质量为10g×70%=7.0g;假设铁红中完全为氧化亚铁,则E中充分反应后得到铁粉的质量为10g×77.8%=7.78g,而;故填:工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4,则E中充分反应后得到铁粉的质量介于7.0g~7.78g之间;故填:7.0;7.78;
②装置F增重的质量即为一氧化碳还原铁的氧化物后生成的二氧化碳的质量,由化学方程式以及质量守恒定律可知,二氧化碳中的氧元素有一半来自于铁的氧化物,质量为:7.7g×$\frac{32}{44}×100%$×$\frac{1}{2}$=2.8g,则此铁红中铁的质量分数是$\frac{10.0g-2.8g}{10.0g}×100%$=72%;故填:72%;
【实验反思】(1)若没有装置G,则F会吸收空气中的水蒸气和二氧化碳而质量偏大,则计算出的氧元素质量偏大,导致测得样品中铁的质量分数偏小,故填:偏小;
(2)一氧化碳有毒,排放到空气中会污染大气,所以实验装置的一个明显缺陷:缺少尾气处理装置;故填:缺少尾气处理装置.
点评 本题通过实验现象和分析,得出结论,属于实验过程和结论的探究.同学们要具体分析,综合掌握,细心解答.


科目:初中化学 来源: 题型:选择题
| A. | CO和C60都属于化合物 | B. | 氮气和氧气都属于非金属单质 | ||
| C. | H2O和C2H5OH都属于氧化物 | D. | 自来水和蒸馏水都属于纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
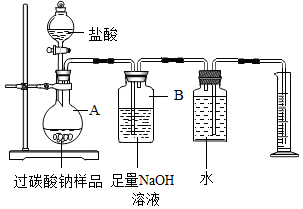 “氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3•3H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究.
“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3•3H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲烷加氧气在点燃条件下,反应生成二氧化碳和水 | |
| B. | 16份质量的甲烷和32份质量的氧气在点燃条件下,生成44份质量的二氧化碳和36份质量的水 | |
| C. | 1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子 | |
| D. | 1 g CH4和2 g O2在点燃条件下,生成1 g CO2和2 g H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | A>B>C | B. | B>A>C | C. | B>C>A | D. | C>B>A |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  浓硫酸 | B. |  冰水混合物 | C. |  24K黄金 | D. |  液化石油气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 正常雨水的pH约为5.6的原因:SO2+H2O=H2SO3 | |
| B. | 医疗上用氢氧化铝中和过多胃酸:2Al+6HCl=2AlCl3+3H2O | |
| C. | 用烧碱溶液除去二氧化碳气体中少量氯化氢气体:NaOH+HCl=NaCl+H2O | |
| D. | 证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl=2FeCl3+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com