

| A. | →CuCl2→NH4Cl→出口 | B. | →Fe→盐酸→出口 | ||
| C. | →Fe→NaCl→C→KNO3→出口 | D. | →CO2→Cu→出口 |
分析 根据题意,“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过;结合碱的化学性质(能与非金属氧化物、酸、一些盐等反应),进行分析解答.
解答 解:A、烧碱能与氯化铜反应生成氢氧化铜沉淀和氯化钠,能与NH4Cl反应生成氯化钠、氨气和水,不符合要求,故选项错误.
B、烧碱不与铁反应,但能与盐酸反应生成氯化钠和水,故选项错误.
C、烧碱不与铁、氯化钠、碳、硝酸钾反应,符合氧气,故选项正确.
D、烧碱与二氧化碳反应生成碳酸钠和水,不符合要求,故选项错误.
故选:C.
点评 本题难度不大,创设情境考查了碱的化学性质,掌握碱的化学性质(能与非金属氧化物、酸、一些盐等反应)是正确解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
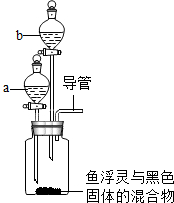 据调查,目前市场有一种产品叫“鱼浮灵”,放在鱼缸中可使水中的含氧量增加,某校科学小组的成员对“鱼浮灵”成分进行探究.
据调查,目前市场有一种产品叫“鱼浮灵”,放在鱼缸中可使水中的含氧量增加,某校科学小组的成员对“鱼浮灵”成分进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
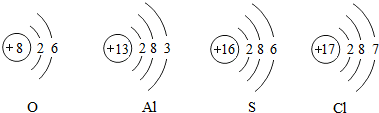
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某化学兴趣小组使用如图所示装置,对某种铁铜合金的成分进行测量,先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在表中,请回答下列问题:
某化学兴趣小组使用如图所示装置,对某种铁铜合金的成分进行测量,先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在表中,请回答下列问题:| 记录时间 | 空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉后 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 |
| 读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验 | 第一次 | 第二次 | 第二次 |
| 给定O2的质量(g) | 4 | 18 | 8 |
| 生成P2O5的质量(g) | 7.1 | 14.2 | 14.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com