
����Ŀ��Ϊ�˲ⶨ����ʯ��Ʒ��̼��Ƶ���������(���ʲ�����Ԫ�أ�������ˮ��Ҳ�����������ʷ�����Ӧ��������������ʵ�飺��ش��������⣺

��1��д������ʵ���з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��2��������֪�����г����10g ����ʯ��Ʒ��̼���������x���ı���ʽΪ_____��
��3���ô���ʯ��Ʒ��̼��Ƶ�����������_____��
��4������ʵ��������Ҫϡ���ᣬ��Ҫ��������Ϊ 36.5%��Ũ�����������_____��
��5�������õĹ�Һ�������ˣ�������Һ���� 6.8g ˮ�����ʱ��Һ���Ȼ��Ƶ�����������_____��
��6��ij����Ҫ���Ƶ� 280t ������ 25%�������ƣ���������Ҫ���ִ���ʯ������Ϊ_____��
���𰸡���1��![]() ����2��
����2��![]() ����3��75%����4��20g����5��7.5%����6��500t
����3��75%����4��20g����5��7.5%����6��500t
��������
��1��ʵ���з�����Ӧ̼�����ϡ���ᷴӦ�����Ȼ��ơ�������̼�����ˮ����ѧ����ʽΪ![]() ��
��
��2���⣺��10g ����ʯ��Ʒ��̼�������Ϊx��
���ɶ�����̼���������Ϊ![]()


�ɴ˿�֪��10g ����ʯ��Ʒ��̼���������x���ı���ʽΪ��![]() ��
��
��3���ô���ʯ��Ʒ��̼��Ƶ���������Ϊ��![]() ��
��
��4����50gϡ�����к��Ȼ��������Ϊy��
��һ�μ���50gϡ��������Ķ�����̼���������Ϊ��![]()


������ʵ��������Ҫϡ���ᣬ��Ҫ��������Ϊ36.5%��Ũ�����������![]() ��
��
��5������Һ���Ȼ��Ƶ�����Ϊz��
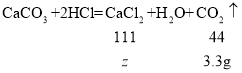

����Һ���Ȼ��Ƶ���������Ϊ![]() ��
��
��6������Ҫ���ִ���ʯ��̼��Ƶ�����Ϊm��
���ɵ������Ƶ�����Ϊ![]()


����������Ҫ���ִ���ʯ������Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��5�£��ҹ������ȼ���Բɳɹ�����ȼ������Դ���ḻ�ĸ�Ч�����Դ�����ͷų����飬��ҵ�ϳ����ü������������÷�Ӧ����ʾ��ͼ��ͼ��ʾ������˵����ȷ���ǣ�������

A.��Ӧǰ����ԭ�ӵĸ��������ı�
B.�÷�Ӧ���ڸ��ֽⷴӦ
C.���������������
D.�÷�Ӧ�Ļ�ѧ����ʽΪCH4+H2 CO+3H2��
CO+3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͯͯͬѧ��һ����������ͭ��ĩ���뵽100g���ʵ���������Ϊ14%��ϡ�����У���ַ�Ӧ�����ȫ����ʧ��Ϊ�˱���÷�Һ�ŷ������Ⱦ���������Һ�м���20g����,��ַ�Ӧ����ˣ�����������Ϊ20g����ϡ����ʱ�����ĵ�����ͭ������()
A.8gB.10gC.12gD.14g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ��ͼ�ش��������⣺

��1��д��ͼ�Тٵ��������ƣ�______��
��2��С��ͬѧ�ø����������������ѡ���� B װ�ã�B װ�ô���һ��������________����װ�����Թܿ�Ҫ��������б��ԭ���� _________������ D װ���ռ������������ķ����ǣ�______________��������˵����
��3��С��ͬѧ�ù���������Һ���������Ϊԭ����ȡһƿ�������������ѡװ����ȷ���� ��˳���ǣ���ܿ��Աߵ�Сд��ĸ��________����ʾ��G װ���е�Ũ���������ˮ�������������壩��
��4��װ�� A �� C ��������Ϊʵ������ȡ�����ķ���װ�ã�A �� C �Ƚϣ�A װ�þ��е��ŵ���_____ ������������ţ�
������������ȡ�϶����� �ڿ����濪���ã������ͣ �ۿ���ʱ����Һ��ҩƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����̽��������ѧ����ʱ����п�ۺ����۵Ļ������뵽ʢ��һ����������������ͭ��Һ���ձ��У���ַ�Ӧ����ˣ��õ���������Һ��ʵ������ͼ1��ͼ2�����������ش��������⣺
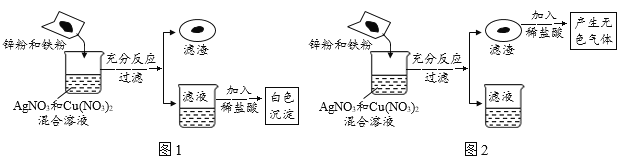
��1��ͼ1������Һ�м���ϡ���ᣬ�۲쵽�а�ɫ����������
����Һ��һ�����еĽ�������Ϊ_____�������ӷ��ţ���
��д��һ�����������ķ�Ӧ�Ļ�ѧ����ʽ_____��
��2��ͼ2���������м���ϡ���ᣬ�۲쵽����ɫ���������
��������һ������_____���ѧʽ����ͬ����
����Һ�п��ܺ���_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס��ҡ������ֹ������ʵ��ܽ�����ߣ������ͼʾ��գ�

��1��t1��Cʱ���ס��ҡ����������ʵ��ܽ�ȴ�С��ϵ��_____��
��2��t2��Cʱ�������ʵı�����Һ�����ʡ��ܼ�������֮��Ϊ_____������������ȣ���
��3����������ͬ�����������ҡ���������Һ��Ӧ�����¶���_____��C��
��4����t2��Cʱ�ס��ҡ����������ʵı�����Һ���ֱ�����t1��C��������Һ���������������Ĵ�С��ϵ��_____��
��5��t2��C����40g������Ͷ��50gˮ�г���ܽ⣬������Һ������Ϊ_____g����ʹʣ����������ȫ�ܽ����ٻ����ˮ������Ϊ_____g��
��6�������к����������Һͱ�ʱ���ɲ���_____�������������������������ᾧ�ķ����ᴿ�����ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�Ȼ��ơ�̼���ƣ��׳ƴ����ˮ�е��ܽ�����ߡ�����˵����ȷ����

A.10 ��ʱ������̼������Һ��������������Ϊ10%
B.20 ��ʱ���Ȼ��ơ�̼�����ܽ����ͬ
C.�����ʺ�ɹ�Σ���Ϊ�Ȼ��Ƶ��ܽ�����¶����߶�����
D.�����ʺ��̼��Ϊ������ܽ�����¶Ƚ��Ͷ����Լ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ���������������Ҫ�����ã�ͼ1Ϊ�ߩ�15�ɻ�������������ɣ�

��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ���______��д��һ�㼴�ɣ���
��2����װǰ�������������⼣�߰ߣ���������ʴ��Ҫ����������е�_______��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽΪ______.
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ������С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺
��ʵ��һ�У�С��������������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ����������������_______��
��ʵ����У�������__����֤�����Ļ��ǿ��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ�������ⶨ��������������������������װ�����������ã���Ӧ��ȫ�ҳ������е����ʲ��μӷ�Ӧ�����س�������Ʒ������Ϊwg����
��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ������������__��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���������غ㶨�ɣ�2gH2��8gO2��ȫ��Ӧ���ɵõ�10gH2O
B.�ú�Fe2O385%�ij�����160t�������Ͽ�����100t������4. 8%������
C.��ȡ10gþ�ۺ�п�ۣ��ֱ���������������ȫ��Ӧ��þ�۲�����H2�࣬˵��þ�Ľ�����Ա�пǿ
D.��l0gCuSO4��5H2O��90gH2O��ϣ�������ȫ�ܽ⣬�ɵ�100g���ʵ���������Ϊ10%��CuSO4��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com