
| A. | 纯净物一定是化合物 | |
| B. | 混合物中元素不一定都是化合态 | |
| C. | 某物质不是化合物就是单质 | |
| D. | 某物质中只含有一种元素,它一定是纯净物 |
分析 A、根据纯净物的种类分析判断;
B、根据混合物中各组成成分的类别分析;
C、根据物质的分类分析判断;
D、根据纯净物的组成分析.
解答 解:A、纯净物包括单质和化合物,某纯净物不是化合物就是单质,故A错误;
B、混合物中各组成成分不一定都是化合物,例如,空气是混合物,空气中既有单质氮气、氧气等,又有化合物二氧化碳等,所以混合物中元素不一定都是化合态,故B正确;
C、物质分为纯净物和混合物,纯净物包括单质和化合物,所以某物质不是化合物也不一定就是单质,还有可能是混合物.故C错误;
D、含一种元素的物质不一定是单质,例如金刚石和石墨组成的混合物中只有一种元素--碳元素.故D错误.
故选:B.
点评 本题的难度不大,准确理解纯净物、单质、化合物的定义及概念间的关系是解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 冰水混合物,净化后的空气 | B. | 液态氧,部分结冰的蒸馏水 | ||
| C. | 矿泉水,澄清石灰水 | D. | 河水,受污染的空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
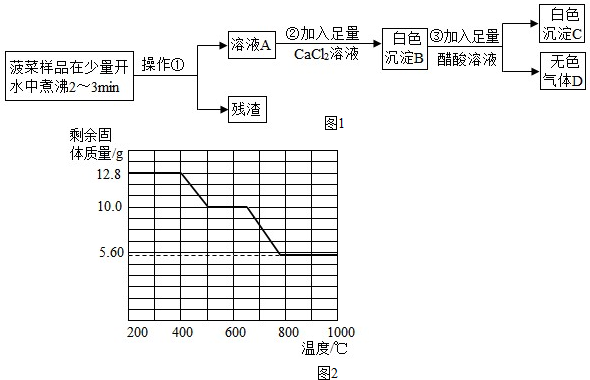
| 实验操作 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验目的 | 实验操作 | 实验现象 |
| ①证明粉末中是否含有铜 | 取一个小烧杯,加入适量的粉末,再向其中加入足量的稀盐酸或稀硫酸. | 有少量红色粉末不能溶解. |
| ②证明粉末中是否含有锰 | 取5.5克粉末放入烧杯,再向其中加入适量的硫酸亚铁溶液,反应完全后过滤、干燥,称量固体为5.52克. | 绿色溶液变为浅粉色. |
| ③证明粉末中是否含有铁 | 另取5.5克粉末,用磁铁充分吸引(用物理方法), 称量剩余金属粉末为1.12克. | 有大量黑色粉末被磁铁吸引. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
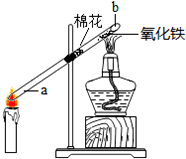 化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.
化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| 点燃酒精灯加热,随即打开弹簧夹,通入干燥的空气. 观察装置B、装置C中的现象 | 装置B中的现象是:黄色试纸变蓝 装置C中的现象是:澄清石灰水变浑浊 | 聚乙烯塑料在空气中燃烧,生成碳的氧化物中,既有CO2,也有CO. 装置C中反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com