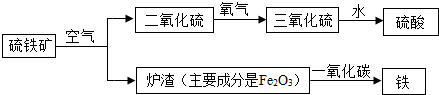
解:Ⅰ.FeS
2中铁元素的质量分数=
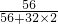
×100%=
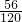
×100%
1000t含FeS
260%的硫铁矿,理论上可以炼出铁:1000t×60%×
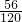
×100%=280t
故答案为:280 吨;
Ⅱ.(1)碘化银是不溶于水的黄色沉淀,根据质量守恒定律,进行可推断物质M为 AgNO
3;
根据书写化学方程式的步骤:写配注等,应方程式为:AgNO+KI=AgI↓+KNO
3;
故答案为:AgNO
3; AgNO+KI=AgI↓+KNO
3;
(2)根据图中操作可知步骤③中“X操作”是过滤;
根据玻璃棒在实验中的作用:溶解时:搅拌,加速溶解; 过滤时:引流;蒸发时:搅拌,使液体均匀受热,防止液体飞溅;由此可知:玻璃棒在步骤②中的作用是引流;
故答案为:过滤;玻璃棒; 引流;
(3)设 一片未知碘片中含KI的质量为 x mg
AgNO+KI=AgI↓+KNO
3
166 235
x 117.5 mg
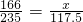
,
解答 x=83 mg
故答案为:83.
分析:Ⅰ.先计算FeS
2中铁元素的质量分数;再根据题意进行解答;
Ⅱ.(1)碘化银是不溶于水的黄色沉淀,根据质量守恒定律,进行推断物质M;
根据书写化学方程式的步骤:写配注等,写出反应方程式;
(2)根据图中操作可知步骤③中“X操作”是过滤;
根据玻璃棒在实验中的作用:溶解时:搅拌,加速溶解; 过滤时:引流;蒸发时:搅拌,使液体均匀受热,防止液体飞溅;进行解答;
(3)根据碘化钾反应的化学方程式进行计算解答.
点评:本题考查学生对过滤玻璃棒的作用的掌握,正确书写化学方程式及根据方程式进行计算解题的能力.


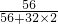 ×100%=
×100%=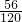 ×100%
×100%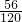 ×100%=280t
×100%=280t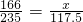 ,
,

 名校课堂系列答案
名校课堂系列答案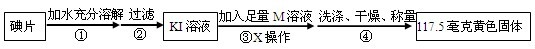
 (2012?天河区一模)(1)CO还原氧化铜的化学方程式是
(2012?天河区一模)(1)CO还原氧化铜的化学方程式是