
【题目】已知:Cu2O+H2SO4═Cu+CuSO4+H2O.16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,将此混合物溶于足量的100.0g稀H2SO4得9.6gCu.下列说法正确的是( )
A. 生成2.4g CO2
B. 混合物中含9.6g铜元素
C. 混合物中Cu与Cu2O的质量之比为8:9
D. 反应后溶液中CuSO4的质量分数约为7.0%
【答案】C
【解析】解:设13.6g的混合物中Cu2O的质量为x,生成的硫酸铜的质量为y;
Cu2O+H2SO4═Cu+CuSO4+H2O 固体质量差量
144 64 160 144-64=80
x y 13.6g-9.6g=4g
![]() ,
, ![]() ;
;
x=7.2g,y=8g;
反应后溶液中CuSO4的质量分数为![]() ×100%≈7.7%,故D错误;混合物中Cu与Cu2O的质量之比为(13.6g-7.2g):7.2g=8:9,故C正确;根据铜元素过程中质量不变,所以铜元素的质量为9.6g+8g×
×100%≈7.7%,故D错误;混合物中Cu与Cu2O的质量之比为(13.6g-7.2g):7.2g=8:9,故C正确;根据铜元素过程中质量不变,所以铜元素的质量为9.6g+8g×![]() ×100%=12.8g,故B错误;16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,根据质量守恒可知,固体质量减少量为失去的氧元素的质量,故失去的氧元素的质量为16.0g-13.6g=2.4g,由于氧化铜和一氧化碳反应,生成的二氧化碳中的一半的氧元素来自氧化铜,所以对应的二氧化碳的质量为2.4g÷(
×100%=12.8g,故B错误;16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,根据质量守恒可知,固体质量减少量为失去的氧元素的质量,故失去的氧元素的质量为16.0g-13.6g=2.4g,由于氧化铜和一氧化碳反应,生成的二氧化碳中的一半的氧元素来自氧化铜,所以对应的二氧化碳的质量为2.4g÷(![]() ×100%×12)=6.6g,故A错误。故选C。
×100%×12)=6.6g,故A错误。故选C。


科目:初中化学 来源: 题型:
【题目】2017年,“共享单车”出现在了哈尔滨的大街小巷,它是共享经济的一种新形态,颇受人们的喜爱.请回答:
(1)普通自行车的车架是由①_____(填合金名称)制成的,该种合金具有②_____(填两点)的物理性质.
(2)某些高档自行车架也用到了碳纤维复合材料或金属钛,钛铁矿(主要成分为FeTiO3)是一种常见的钛矿石,已知其中两种金属元素的化合价相同,则这两种金属元素的化合价均为_____价.
(3)“共享单车”不但经济,而且环保.普通燃油汽车行驶时的能量转化为:①_____→内能→②_____.和燃油汽车的尾气排放相比,骑乘共享单车,可以有效减少空气中③_____(填两种有害物质)的含量,从而真正改善我们的生活环境.

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知两种活动性不同的金属在能导电的溶液中接触可以形成原电池,从而加快化学反应速率.在实验室里,我们常用锌与稀硫酸反应来制取氢气(装置如图所示).
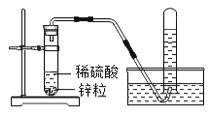
(1)实验室用锌与稀硫酸反应制取氢气的化学方程式为___________.
(2)实验室也可用锌与盐酸反应来制取氢气,但制得的氢气中往往含有HCl气体,若将制得的气体通过盛有NaOH溶液的洗气瓶,_______(填“能”或“不能”)得到纯净的氢气.
(3)点燃氢气之前,先要进行的操作是__________________.
(4)锌与稀硫酸反应时,加入某些盐溶液可使制取H2的速率加快,如__________溶液.
(5)图示装置,_____(填“能”或“不能”,药品可换)用来制取CO2气体.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映其对应操作中各量变化关系的是( )
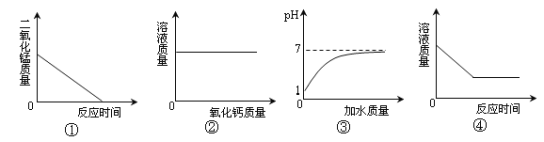
A.图①是给氯酸钾和二氧化锰的混合物加热
B.图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体
C.图③是向pH=1的酸溶液中不断加水
D.图④是向一定质量的稀硫酸中加入锌粒
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量/g | 10.8 | 9.6 | 8.1 | 8.1 |
试计算:
(1)完全反应后生成二氧化碳的质量为____________g;
(2)求该珍珠粉中碳酸钙的质量分数为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜、铁是人类使用最早、应用广泛的金属.
(一)对古代制品的认识
青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
(1)上述制品不涉及到的材料是______(选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
(2)如图1为出土文物古代青铜铸件“马踏飞燕”.该文物能保存至今的原因可能是_____(选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(二)铁、铜的冶炼
①我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式:_________,2CuO+C![]() 2Cu+CO2↑.
2Cu+CO2↑.
②铁、铜矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2)、黄铜矿(CuFeS2)等.CuFeS2为二硫化亚铁铜,其中S元素的化合价为______.
(1)工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为______________.
炼铁不采用黄铁矿、黄铜矿,可能的原因是:
①黄铁矿、黄铜矿含铁量相对低;②________________________________.
(2)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS2+17O2+2H2SO4![]() 4CuSO4+2Fe2(SO4)3+2H2O.
4CuSO4+2Fe2(SO4)3+2H2O.
向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu.
①发生主要反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4,________________________.
②FeSO4溶液经蒸发浓缩、___________、过滤等操作得到FeSO47H2O晶体.
(三)黄铜矿中铁、铜含量的测定
在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe2O3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO4、Fe2(SO4)3溶液.向溶液中加入过量NaOH溶液得到Cu(OH)2、Fe(OH)3固体.
(1)证明NaOH溶液过量的方法:静置,向上层清液中滴加________溶液,无现象.
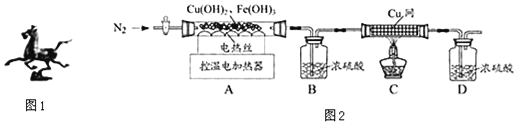
(2)用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH)2分解为CuO;在500℃时,Fe(OH)3分解为Fe2O3.
②在1400℃时,CuO分解为Cu2O和O2,Fe2O3分解为复杂的铁的氧化物和O2.
(1)装配好实验装置后,先要________________.
(2)停止加热后仍需继续通N2,可防止倒吸和______________________________.
(3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
温度/℃ | 室温 | 100 | 550 | 1400 |
B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%=________;ω(Fe)%=__________.
②复杂的铁的氧化物化学式为__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
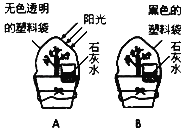
【题目】探究:植物光合作用与呼吸作用的比较:植物不但进行光合作用,也同时进行呼吸作用.为了比较二者的不同,有人设计了如下实验.在一晴朗的早晨,选取大小相似的同种植物两盆,在花盆上各放入一杯澄清的石灰水,然后把其中一盆用无色透明的塑料袋罩住,放在阳光下;另 一盆则用黑色塑料袋罩住,放在阴暗处(见如图).傍晚,在塑料袋上都剪一小口,并插入燃着的木条试验,发现A中木条比B中更亮;而A中的石灰水保持澄清,B中变浑浊.
(1)A中木条燃烧更旺,说明A中_____更多,从而说明在阳光照射下植物主要发生_____作用.
(2)A中石灰水保持澄清,而B中变浑浊,说明B中_____更多,从而说明在缺少光照条件下,植物主要发生_____作用.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示某反应的微观示意图,其中“![]() ”“
”“ ![]() ”“
”“![]() ”分别表示A、B、C三种不同的分子。该反应的化学方程式中A、B、C的化学计量数之比为
”分别表示A、B、C三种不同的分子。该反应的化学方程式中A、B、C的化学计量数之比为
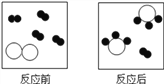
A. 4:3:1 B. 4:1:2 C. 3:1:3 D. 3:1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。
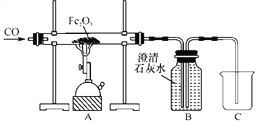
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却。
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为________(填化学式),B瓶中澄清石灰水变浑浊,该反应的化学方程式为____________________________。
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是________________________。
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO
②检验并吸收反应生成的CO2
上述说法中正确的是________。
A.只有① B.只有②
C.①和②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com