
【题目】断血流滴丸主要含有木犀草素(化学式为C13H2Ox)等黄酮类活性成分,具有止血、抗菌、抗炎及免疫等药理活性。已知木犀草素的相对分子质量为254,请计算:
(1) 木犀草素是由 种元素组成,x的值为 。
(2) 木犀草素中碳、氢元素的质量比为 (最简比)。
(3) 木犀草素中碳元素的质量分数是多少?(结果精确到0.1%)
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:初中化学 来源: 题型:
【题目】人类的生产生活离不开金属.
(1)金属铁、铝常用来制作炊具,主要是利用其_______________性.
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁.赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为______________________________________.
(3)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人.工业上常用稀盐酸除去铁锈,该反应的化学方程式为___________________________________________.
(4)从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下.
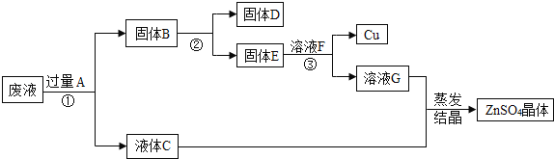
请回答:
写出步骤①中发生反应的化学方程式__________________________________________;固体D的化学式为_____;以上物质A~G中,含有锌元素的是_______(填字母序号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校学生宿舍发生粉尘爆炸事故,起因是学生庆祝生日,在蜡烛仍未熄灭之际,有人互撒面粉,导致粉尘爆炸,酿成悲剧。请回答:
(1)堆积的面粉只是小火燃烧,不易发生爆炸,而撒面粉时增大了______________, 从而使面粉剧烈燃烧,引发爆炸。
(2)下列关于燃烧和爆炸的说法正确的是________________。
A 燃烧不一定会引起爆炸
B 在空气中不燃烧的物质,在氧气里也一定不燃烧
C 物质燃烧的剧烈程度与氧气的量有关
D CO 和 N2 的混合气体遇明火会发生爆炸
(3)发生爆炸后,消防员用高压水枪灭火,该方法主要的灭火原理是___________________ 。
(4)为了研究其他的灭火方法,小明用生活中的泡腾片做了图 1 的实验。往水中加入泡腾片,观察到产生大量气泡,蜡烛逐渐熄灭。泡腾片的标签如图 2 所示。

①由图1 实验可知,该气体具有的化学性质是________________________(写一条)。
②写出维C泡腾片中一种盐的化学式________________________。
③将维 C 泡腾片投入水中,观察到有大量气泡产生,主要是因为柠檬酸和_____________发生反应,生成____________________,从而使蜡烛熄灭。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某反应前后分子变化的微观示意图如图,下列说法正确的是( )
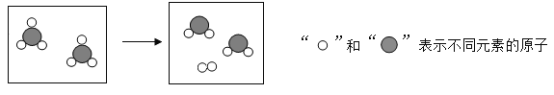
A.反应物与生成物共有3种物质B.反应后分子个数不变
C.该图可示意CO与O2的反应D.反应物中元素的化合价都为0
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将80gM物质加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,按要求填空。

(1) 由图可知,物质M的溶解度随温度升高而_____________________。
(2) 20℃时,M物质的溶解度为____________,A点时,该溶液的溶质质量分数为_________________。
(3)A、B、C三点所对应的溶液,属于饱和溶液的是______________(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H都是初中化学常见的物质,它们的转化关系如图所示。A、B均为黑色粉末;D、F均为红色固体,且D为单质,F为氧化物;C能使澄清石灰水变浑浊。请回答:
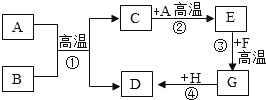
(1)反应①的化学方程式为______________________,该反应的现象为_________;
(2)反应④的化学方程式为________________________________________;
(3)写出E的一种用途______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】往200 克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH 变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:

(1)b点溶液中所含的溶质是 ;
(2)c→d 段溶液的 pH 大于 7 的原因是 ;
(3)反应结束时,生成沉淀的质量是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
(查阅资料)侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(实验探究)小明以粗盐配制饱和食盐水,并采用下列装置模拟制备碳酸氢钠,进而制得碳酸钠。
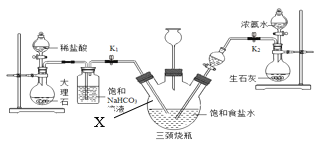
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式_____,再过滤,然后向滤液中加入适量_____,得到氯化钠溶液。
(2)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为_____。上述实验装置图中仪器X名称_____。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是_____,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是_____;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是_____。
(4)根据实验记录,计算t2时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____。
(拓展延伸)小华设计如图的实验装置测定某纯碱样品(含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。

(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是_____(填字母)。
A 500mL B 1000mL C 1500mL D 2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是_____。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类和类比是学习化学常用方法。
(1)化学是一门以实验为基础的科学,下面是我们在初中化学课本经历的实验:
|
|
|
|
A | B | C | D |
根据化学方程式提供的信息将上述实验平均分两类,选出的一组实验是_____。你的分类依据是_____。
(2)已知H2、CO、C是初中常见的还原剂,请根据它们还原氧化铜的方程式中各元素化合价的变化情况,分析在反应![]() 中作为还原剂的是_____,该反应的氧化剂中发生改变的元素,其化合价的变化情况是_____。
中作为还原剂的是_____,该反应的氧化剂中发生改变的元素,其化合价的变化情况是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com