
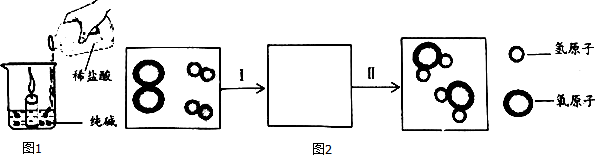
分析 (1)燃烧的条件是:①物质具有可燃性,②可燃物与氧气接触,③温度达到可燃物的着火点,三个条件必须同时具备,缺一不可;据此结合事实进行分析判断.
(2)根据稀盐酸和纯碱反应,生成二氧化碳,二氧化碳不支持燃烧分析;
(3)根据氢气与氧气反应生成水来书写方程式;根据化学反应的微观实质分析.
解答 解:(1)蜡烛和煤块的着火点不同,火柴燃烧放出的热量有限,可以使石蜡的温度达到着火点,不能使煤的温度达到其着火点,所以用一根划着的火柴能点燃一支蜡烛,却点不着一块煤,故填:火柴燃烧放出热量,使温度达到蜡烛的着火点,没有达到煤的着火点;
(2)稀盐酸和纯碱反应生成二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛与氧气隔绝,所以烧杯中蜡烛迅速的熄灭;故答案为:稀盐酸和纯碱反应生成二氧化碳,二氧化碳不燃烧也不支持燃烧,使蜡烛不能与氧气(或空气)接触.
(3)氢气与氧气反应生成水,化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;化学变化的实质是反应物的分子分成原子,原子又重新结合为新的分子的过程,图2为氢气燃烧的微观过程示意图,其步骤Ⅰ的微观过程为氧气分子分解为氧原子,氢气分子分解为氢原子,步骤Ⅱ的微观过程为氢原子与氧原子结合成水分子.故填:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;氢原子与氧原子结合成水分子.
点评 本题考查了燃烧的条件和灭火的方法以及微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 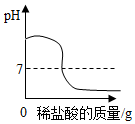 向盛有NaOH溶液的烧杯中滴加稀盐酸 | |
| B. | 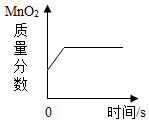 加热氯酸钾和二氧化锰的固体混合物 | |
| C. | 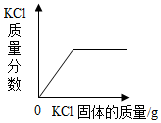 在一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体 | |
| D. | 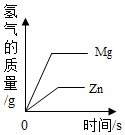 将质量相等的镁粉和锌粉分别加入到足量且质量分数相等的稀硫酸中 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A、侯氏制碱 | B、蚕丝纺织 | C、火药应用 | D、粮食酿酒 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Zn2+、NH4+、NO3-、OH- | B. | H+、Na+、HCO3-、Cl- | ||
| C. | Ba2+、H+、Cl-、Fe2+ | D. | K+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.30g | B. | 0.20g | C. | 0.15g | D. | 0.45g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
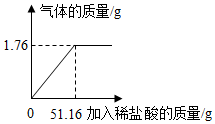 某化学兴趣小组为了测定某纯碱样品(只含有Na2CO3、NaCl)中Na2CO3质量分数,取5克样品,往其中加入一定质量的稀盐酸,产生气体的质量与所加稀盐酸的质量变化如图,试计算:
某化学兴趣小组为了测定某纯碱样品(只含有Na2CO3、NaCl)中Na2CO3质量分数,取5克样品,往其中加入一定质量的稀盐酸,产生气体的质量与所加稀盐酸的质量变化如图,试计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4:13 | B. | 3:10 | C. | 2:7 | D. | 1:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
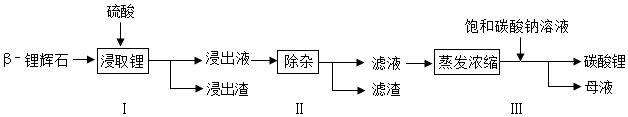
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
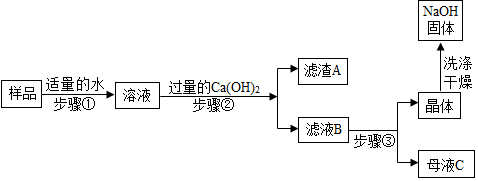
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com