(2010?哈尔滨模拟)某工厂欲对某铝制品的样品中单质铝的纯度进行测量(假设其他成分不含铝元素,且
不溶于水,也不与酸反应),请回答下列问题:
(1)配制200g的质量分数为14.6%的稀盐酸,需36.5%的浓盐酸的质量是 ______.
(2)铝跟稀盐酸反应的化学方程式是 ______.
(3)若将铝样品制成粉末,取6g粉末与200g 1~14.6%的稀盐酸充分反应后,称得固液混合物质量为205.4g,则求解6g铝样品中单质铝(x)的比例式为 ______.
(4)此铝样品中单质铝的质量分数为 ______.
(5)若6g铝样品中的单质铝与150g上述稀盐酸恰好完全反应,再蒸发掉21.3g水后仍为不饱和溶液,则所得溶液中溶质的质量分数为 ______.
【答案】
分析:(1)中可看作是溶液稀释问题的计算,根据稀释前后溶液中溶质的质量不变,列出等式即可求解.(2)(3)中要求会写铝与盐酸反应的化学方程式,然后根据化学方程式即可列出比例式.(4)中根据前一步求出的铝的质量,用铝的质量和铝样品的质量比便可求出铝样品中单质铝的质量分数.(5)中,根据化学方程式先求出生成的氯化铝的质量和氢气的质量,然后根据质量守恒定律便可求出反应后所得溶液的总质量,这样便可轻松求解.
解答:解:(1)设需要浓盐酸的质量为X.
200g×14.6%=X?36.5%
X=80g
故答案为:80g
(2)书写化学方程式时要注意铝元素的化合价为+3价.答案为:2Al+6HCl=2AlCl
3+3H
2↑
(3)解:设6g铝样品中单质铝的质量为X.
2Al+6HCl=2AlCl
3+3H
2↑
54 6
x (200+6-205.4)克
∴
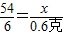
故答案为:

(4)通过上面可求出6g铝样品中单质铝的质量为5.4克.所以此铝样品中单质铝的质量分数=
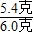
×100%═90%
故答案为90%.
(5)解:设6g铝样品中的单质铝与150g上述稀盐酸恰好完全反应生成氯化铝的质量为X、同时生成氢气的质量为Y.
2Al+6HCl=2AlCl
3+3H
2↑
54 267 6
5.4克 X Y
∴
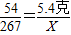
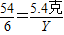
X=26.7克 Y=0.6克
据题意可知所得溶液的质量为5.4克+150克-0.6克-21.3克=133.5克
所以所得溶液中溶质的质量分数=

×100%=20%
故答案为20%.
点评:本题考查了学生对:金属与酸反应的化学方程式的掌握以及有关溶液中溶质的判断,反应后所得溶液的质量求法的掌握,反应后所得溶液质量的求法利用质量守恒定律求解是最简单的一种方法.该题难度比较大.

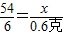

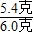 ×100%═90%
×100%═90%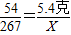
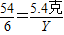
 ×100%=20%
×100%=20%








