
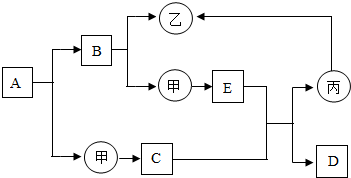
 如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质;A、B、C、D、E为同类化合物,且A与B的组成元素相同,D与E的组成元素也相同.已知C为红色固体、丙为黑色粉末,C和E在高温条件下可生成丙和D,D能使澄清的石灰水变浑浊.其余反应条件、部分反应物和生成物均已略去.试推断:
如图是初中化学中常见物质间的转化关系,其中甲、乙、丙为单质;A、B、C、D、E为同类化合物,且A与B的组成元素相同,D与E的组成元素也相同.已知C为红色固体、丙为黑色粉末,C和E在高温条件下可生成丙和D,D能使澄清的石灰水变浑浊.其余反应条件、部分反应物和生成物均已略去.试推断:分析 甲、乙、丙为单质;A、B、C、D、E为同类化合物,且A与B的组成元素相同,D与E的组成元素也相同.已知C为红色固体、丙为黑色粉末,C和E在高温条件下可生成丙和D,D能使澄清的石灰水变浑浊,则D是二氧化碳;化合物B分解生成两种单质,水电解生成氢气和氧气,所以可知B是水,则A为过氧化氢;乙、甲是氢气和氧气中的一种,乙又可以由丙单质转化生成,则乙是氢气,甲是氧气;丙是活泼的金属,铁是黑色粉末状的金属,丙是铁;E、D的元素相同能会和C转化成铁,E是一氧化碳;C为红色固体与一氧化碳反应会生成铁和二氧化碳,则C是氧化铁,铁生锈能生成氧化铁;据此进行分析解答.
解答 解:甲、乙、丙为单质;A、B、C、D、E为同类化合物,且A与B的组成元素相同,D与E的组成元素也相同.已知C为红色固体、丙为黑色粉末,C和E在高温条件下可生成丙和D,D能使澄清的石灰水变浑浊,则D是二氧化碳;化合物B分解生成两种单质,水电解生成氢气和氧气,所以可知B是水,则A为过氧化氢;乙、甲是氢气和氧气中的一种,乙又可以由丙单质转化生成,则乙是氢气,甲是氧气;丙是活泼的金属,铁是黑色粉末状的金属,丙是铁;E、D的元素相同能会和C转化成铁,E是一氧化碳;C为红色固体与一氧化碳反应会生成铁和二氧化碳,则C是氧化铁,铁生锈能生成氧化铁.
(1)D物质的化学式是CO2.
(2)B→甲+乙,即水通电分解生成氢气和氧气,反应的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
C+E→丙+D,即一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
甲→E,即碳在氧气中不充分燃烧生成一氧化碳,反应的化学方程式为2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO.
故答案为:(1)CO2;(2)2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
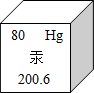 首个国际防治汞污染公约正式出台,如图为汞元素在周期表中的一格,下列说法不正确的是( )
首个国际防治汞污染公约正式出台,如图为汞元素在周期表中的一格,下列说法不正确的是( )| A. | 汞元素的原子序数为80 | B. | 汞的相对原子质量为200.6 | ||
| C. | 该元素为非金属元素 | D. | 汞原子核外有80个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com