
| A. | CuCl2、NaOH、HCl、H2SO4 | B. | BaCl2、K2SO4、K2CO3、HCl | ||
| C. | HCl、NaNO3、Na2CO3、Na2SO4 | D. | AgNO3、HCl、NaCl、HNO3 |
分析 不用其他试剂,就能将组内物质鉴别出来,首先需考虑物质的颜色,然后将鉴别出来的物质与其他物质混合,根据现象的不同加以鉴别,若物质都是没有颜色,则让溶液之间两两混合,根据不同的实验现象加以鉴别.
解答 解:A、可先鉴别出蓝色的CuSO4溶液,再将CuSO4溶液滴入剩下的三种试剂中,产生蓝色沉淀的NaOH,但HCl、H2SO4均不和CuSO4溶液反应,故A错误;
B、采用溶液互滴法,碳酸钾和盐酸反应产生气泡,和氯化钡反应产生沉淀,因此既能产生沉淀又能够产生气泡的是碳酸钾,和碳酸钾产生气泡的是盐酸,产生沉淀的是氯化钡,剩下的为K2SO4,因此可鉴别出四种物质,故B正确;
C、只有稀盐酸和碳酸钠反应产生气泡,与NaNO3、Na2SO4都不反应,但无法鉴别哪一个是稀盐酸,哪一个是碳酸钠,故C不正确;
D、盐酸和氯化钠都能够和硝酸银反应产生白色沉淀,现象相同,因此应用互滴法无法鉴别稀盐酸和氯化钠,故D错误.
故答案为:B.
点评 本题考查了常见物质的鉴别,不用其他试剂,应该采用供检物质两两混合的方式,根据物质的溶液颜色以及物质间反应实验现象进行,要求同学们掌握基础知识,以便灵活应用.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应前物质的质量/g | 反应后物质的质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液 |
| 4.0 | 10 | 11.26 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
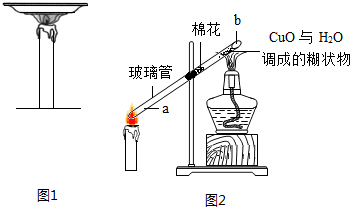
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 无白色沉淀 | 水垢中无Ca(OH)2 |
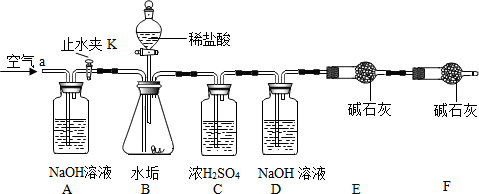
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com