


科目:初中化学 来源: 题型:
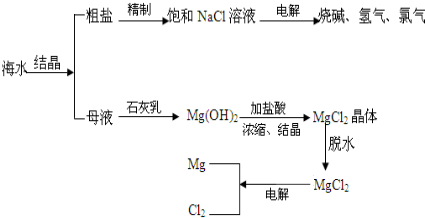
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 目的 | 实验操作步骤 | 预期现象和结论 |
| ① | 另取少量原澄清石灰水于试管,然后滴加足量Na2CO3溶液 另取少量原澄清石灰水于试管,然后滴加足量Na2CO3溶液 |
若无明显现象,则原石灰水已经失效,猜想①正确;若溶液变浑浊,则原石灰水没有失效,猜想①不正确 若无明显现象,则原石灰水已经失效,猜想①正确;若溶液变浑浊,则原石灰水没有失效,猜想①不正确 |
| ② | 取通气后没有变浑浊的石灰水于试管,然后滴入酸化的硝酸银溶液(或:取酸化的硝酸银溶液于试管中,然后通入制得的气体) 取通气后没有变浑浊的石灰水于试管,然后滴入酸化的硝酸银溶液(或:取酸化的硝酸银溶液于试管中,然后通入制得的气体) |
若溶液有白色沉淀生成,则CO2中混有HCl,猜想②正确;若溶液没有明显现象,则CO2中没混有HCl,猜想②不正确 若溶液有白色沉淀生成,则CO2中混有HCl,猜想②正确;若溶液没有明显现象,则CO2中没混有HCl,猜想②不正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源:模拟题 题型:实验题
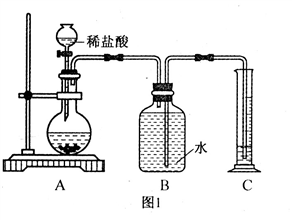
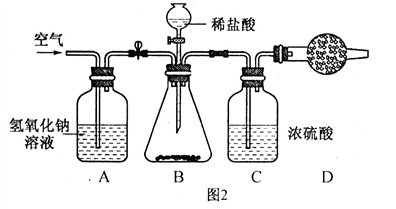
查看答案和解析>>
科目:初中化学 来源: 题型:
在一次探究活动中,小强用塑料吸管向新制的澄清石灰水中不断吹气,在吹气的过程中发现石灰水先出现浑浊后又变澄清,他感到很意外。小强又将纯净的CO2持续通入新制的澄清石 灰水中,一段时间后,观察到的现象与上次相同。
灰水中,一段时间后,观察到的现象与上次相同。
(1)小强做第二次实验的目的是 ▲ 。
(2)小强从老师那里得知:CO2能与CaCO3和H2O继续反应生成Ca(HCO3)2。由此
小强推测出Ca(HCO3)2的一条物理性质是 ▲ 。
(3)已知实验老师配置新制的澄清石灰水时是用生石灰配制而成,请写出该反应的化学方程式 ▲ 。工业上所用的生石灰是由石灰石煅烧而成(已知:CaCO3 CaO+CO2↑)。如果煅烧含杂质10%的石灰石100 t(杂质不参与反应),可制得含氧化钙80%的生石灰的质量是多少?(写出计算过程)
CaO+CO2↑)。如果煅烧含杂质10%的石灰石100 t(杂质不参与反应),可制得含氧化钙80%的生石灰的质量是多少?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com