
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的质量/g | 50g | 50g | 50g | 50g |
| 剩余固体的质量/g | 43.5g | 37.0g | 30.5g | 30.5g |
分析 (1)根据质量守恒定律,第3次再加入50g稀硫酸时,剩余固体还能在减少,说明前两次加入的硫酸完全参加了反应,据此由第4次再加入50g稀硫酸时,固体的质量不变,说明剩余固体全部为铜,则剩余的固体30.5g的成分是铜;
(2)根据上述分析可知,50g稀硫酸完全反应时反应掉了50g-43.5g=6.5g的锌.根据反应的化学方程式,可求出50g稀硫酸中参加反应硫酸的质量,根据溶质质量分数的计算公式,可以求出所用稀硫酸中硫酸的质量分数;
解答 解:(1)据此由第4次再加入50g稀硫酸时,固体的质量不变,说明剩余固体全部为铜,则剩余的固体30.5g的成分是铜;
(3)由第一次加酸数据可知,可知50g稀硫酸能够消耗锌的质量是50g-43.5g=6.5g
设50g稀硫酸中硫酸的质量为x
H2SO4 +Zn═ZnSO4+H2↑
98 65
x 6.5g
$\frac{98}{x}=\frac{65}{6.5g}$
解得:x=9.8g
稀硫酸中硫酸的质量分数为:$\frac{9.8g}{50g}$×100%=19.6%
故答案为:(1)30.5;(2)19.6%;
点评 本题主要考查合金中金属与酸的反应及合金中金属质量分数的计算等,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.


科目:初中化学 来源: 题型:解答题
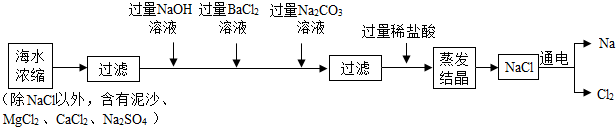
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用食盐制纯碱需要含碳、氧元素的物质 | |
| B. | 氨盐水比食盐水更易吸收二氧化碳 | |
| C. | (1)中析出晶体后剩余溶液中只有一种溶质 | |
| D. | 碳酸氢钠比碳酸钠受热更易分解 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
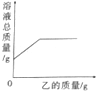 在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )| 序号 | 甲 | 乙 |
| A | HCl溶液 | Zn粒 |
| B | 石灰水 | 二氧化碳 |
| C | H2SO4溶液 | NaOH溶液 |
| D | AgNO3溶液 | Cu粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2SO4 Mg(OH)2 KCl | B. | Cu(NO3)2 NaCl KNO3 | ||
| C. | Na2CO3 KNO3 NH4NO3 | D. | MgSO4 NaNO3 KCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
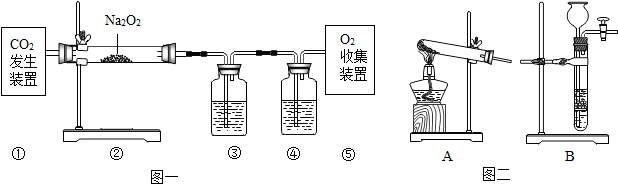
 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:| 试验编号 | 1 | 2 |
| 反应物 | 6%的过氧化氢 | 6%的过氧化氢 |
| 催化剂 | 1g红砖粉 | 1g二氧化锰 |
| 时间 | 152s | 35s |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com