
分析 (1)根据金属活动性顺序表的应用分析:排在氢前面的金属可置换出酸中的氢元素;
(2)根据合金的性质与纯金属的关系分析回答;
(3)根据铝在空气容易形成致密的氧化物,因此抗腐蚀性能很好进行分析.
解答 解:(1)在金属活动性顺序表中,铜排在氢的后面,铜与稀硫酸不能反应;故答案为:在金属活动性顺序表中,铜排在氢的后面,铜与稀硫酸不能反应,因此不能制取氢气;
(2)合金的硬度一般大于纯金属的硬度,将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜>纯铜;故答案为:黄铜的硬度大于纯铜;
(3)铝在空气容易形成致密的氧化物,所以铝在空气中具有很好的抗腐蚀性能的原因是:铝与空气中的氧气反应,表面形成致密的氧化铝薄膜;故答案为:铝与空气中的氧气反应,表面形成致密的氧化铝薄膜.
点评 与生产、生活相关的知识是中考考查的热点之一,灵活运用所学知识是正确解答本题的关键.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑥ | C. | ②③⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
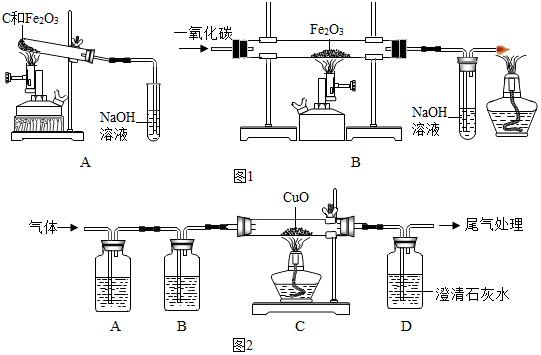


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 钠发生了氧化反应 | ||
| C. | 钠元素化合价降低 | D. | CO2是氧化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 参加反应的X、Y两物质的粒子个数比为1:1 | |
| B. | 化学反应前后原子的种类、个数、质量均保持不变 | |
| C. | W物质中碳元素的质量分数为75% | |
| D. | 该反应属于置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
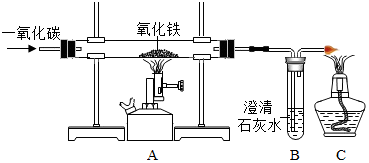
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com