
 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH, 而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入氯化钙溶液 | 产生白色沉淀 | 固体产物是Na2CO3, 而不是NaOH |
| 实验三:取少量反应后的固体产物,加入过量稀盐酸(或稀硫酸、稀硝酸、醋酸) | 产生大量气泡 | 固体产物是Na2CO3, 而不是NaOH |
分析 实验部分由于已经假设了加热后的固体产物是NaOH或Na2CO3,所以应分析下面肯定是要利用NaOH和Na2CO3性质的不同点来设计实验,才能得到正确结论.而不能用NaOH和Na2CO3的共同性质来设计实验,如NaOH和Na2CO3溶液都呈碱性,所以不能用滴酚酞试液来设计实验.碳酸氢钠与盐酸反应,生成氯化钠、水和二氧化碳;根据质量关系图,当加入25.1稀盐酸时恰好完全反应,放出气体二氧化碳的质量为4.4g;
由产生二氧化碳气体的质量计算样品中碳酸氢钠的质量;
解答 解:(1)因为已经知道碳酸氢钠受热分解时有水生成,所以加热一段时间后,倒扣的烧杯内壁有水珠出现;
(2)二氧化碳使澄清石灰水变浑浊的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O
(3)①根据质量守恒定律可知化学反应前后元素种类不变,因为NaHCO3中含有Na、H、C、O元素,所以兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
②实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液,因为NaOH和Na2CO3中只Na2CO3有和氯化钙溶液反应生成白色沉淀,所以实验现象为:产生白色沉淀;实验三的实验现象是产生大量气泡,而NaOH和Na2CO3中只有Na2CO3和酸反应会产生二氧化碳气体,所以实验步骤为:取少量反应后的固体产物,加入过量稀盐酸.
【讨论与评价】实验一的结论明显是不正确的,因为NaOH和Na2CO3的溶液都显碱性,都能使滴酚酞试液变红.
【总结】通过实验二和实验三可知碳酸氢钠受热分解后的固体产物是Na2CO3,所以碳酸氢钠受热分解的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(4)设样品中碳酸氢钠的质量为x,生成氯化钠的质量为y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
x 4.4g
$\frac{84}{x}=\frac{44}{4.4g}$
x=8.4g
样品中碳酸氢钠的质量分数=$\frac{8.4g}{10g}$×100%=84%
故答案为:(1)水珠(或水雾等);
(2)Ca(OH)2+CO2=CaCO3↓+H2O;
(3)①质量守恒定律(或化学反应前后元素种类不变或化学反应前后原子种类不变或NaHCO3中含有Na、H、C、O元素)
②
| 实验 | 实验现象 |
| 方案二: | 产生白色沉淀 |
| 方案三:取少量反应后的固体产物,加入过量稀盐酸(或稀硫酸、稀硝酸、醋酸) |
点评 此题是一道实验设计题,因为此题已经给出了碳酸氢钠受热分解后的固体产物可能是NaOH或Na2CO3,不用学生探究碳酸氢钠受热分解后的固体是什么,使此题的难度有所降低.另外此题也很好的考查了学生们对重要化学方程式的记忆.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
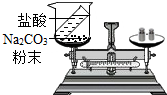 质量守恒定律的定量研究对化学科学发展具有重大作用.
质量守恒定律的定量研究对化学科学发展具有重大作用.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 物质都是由原子和分子构成的 | |
| B. | 化学变化的基础是分子中原子的重新组合 | |
| C. | 门捷列夫发现了元素周期律并编制出元素周期表 | |
| D. | 化学在劳动人民与自然界的种种灾难进行的斗争中不断发展. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 相同条件下跟酸溶液反应生成氢气的质量,铝比铁多 | |
| B. | 相同条件下跟酸溶液反应,铝的反应速度比铁快 | |
| C. | 铁能把铝从氯化铝溶液中置换出来 | |
| D. | 相同条件下,铝、铁都能将硫酸铜溶液中的铜置换出来 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示,将若干个正在萌发的种子放入广口瓶中一段时间,萌发的种子进行呼吸作用消耗氧气,则在测定过程中,U形管中的B液面下降(填“A”或“B”),其原因是呼吸作用消耗O2,释放二氧化碳,放出CO2 被氢氧化钾溶液吸收,导致瓶内气压减小.
如图所示,将若干个正在萌发的种子放入广口瓶中一段时间,萌发的种子进行呼吸作用消耗氧气,则在测定过程中,U形管中的B液面下降(填“A”或“B”),其原因是呼吸作用消耗O2,释放二氧化碳,放出CO2 被氢氧化钾溶液吸收,导致瓶内气压减小.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com