
 =32%;
=32%; CaO+CO2↑
CaO+CO2↑ x=35.2g
x=35.2g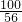 =
= y=44.8g
y=44.8g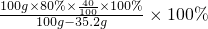 ≈49%
≈49%

科目:初中化学 来源: 题型:解答题
 小明购得用于食用菌种植的轻质碳酸钙,标签如图.为测定其含钙量小明进行的实验是:①称取样品5.6g;②加入足量7.3%的盐酸充分反应,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;③将所生成的全部气体除杂干燥后,通入100g氢氧化钠浓溶液,反应后此溶液总质量为102.2g.请计算,并回答下列有关问题:
小明购得用于食用菌种植的轻质碳酸钙,标签如图.为测定其含钙量小明进行的实验是:①称取样品5.6g;②加入足量7.3%的盐酸充分反应,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;③将所生成的全部气体除杂干燥后,通入100g氢氧化钠浓溶液,反应后此溶液总质量为102.2g.请计算,并回答下列有关问题:查看答案和解析>>
科目:初中化学 来源:福建省中考真题 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com