
| 试液编号药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
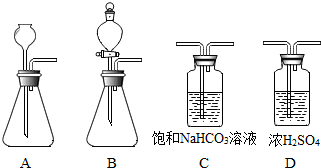
| 方案编号 | 方案 | 实验现象 | 结论 |
| 一 | 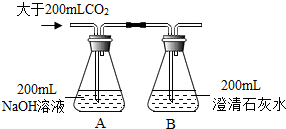 | A、B瓶均无明显现象 | 二氧化碳确与氢氧化钠反应了 |
| 二 | 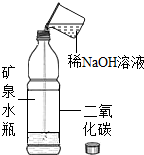 加入NaOH溶液后,盖好瓶盖,振荡 | 塑料瓶变瘪 | 二氧化碳确与氢氧化钠反应了 |
| 三 | 往二氧化碳和氢氧化钠溶液作用后的液体中加入稀盐酸 | 有气泡产生 | 二氧化碳确与氢氧化钠反应了 |
分析 (1)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
进行对比试验要设计好常量和变量;
反应物浓度越大,单位体积的微粒就越多,碰撞的机会就越大;
分液漏斗能够控制液体药品的流量,从而可以控制反应速率;
浓硫酸具有吸水性,可以用来干燥氢气、氧气、二氧化碳等气体;
(2)二氧化碳能使澄清石灰水变浑浊;
二氧化碳和氢氧化钠反应生成碳酸钠和水;
二氧化碳能够溶于水;
碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳.
解答 解:(1)①实验室制取二氧化碳的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故填:CaCO3+2HCl=CaCl2+H2O+CO2↑.
②若要研究盐酸浓度大小对反应速率的影响,可选择实验甲与实验乙进行对照实验,因为甲和乙中大理石形状相同,盐酸浓度不同.
故填:乙.
③若要研究反应物的接触面积对反应速率的影响,可选择实验甲与实验丙进行对照实验,因为甲和丙中大理石形状不同,盐酸浓度相同.
故填:丙.
④化学反应的实质是微观粒子相互接触、碰撞的结果,试从微观角度解释“反应物的接触面积越大,化学反应速率越快”的原因是:反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快.
故填:反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快.
⑤乙和丁相比较,盐酸浓度相同,丁与盐酸接触面积更大,因此产生气体的速率较快;
完全反应后,由于碳酸钙质量相等,因此产生二氧化碳的质量相等.
故填:丁;相等.
⑥为了能得到较平稳的气流,应选择如图装置中的B,理由是分液漏斗可以控制盐酸加入的速率,从而控制反应的速率;
为了得到干燥、纯净的二氧化碳,可将产生的二氧化碳依次通过下列装置中的C、D,通过C装置可以除去氯化氢气体,通过D装置可以除去水蒸气.
故填:B;分液漏斗可以控制盐酸加入的速率,从而控制反应的速率;C、D.
(2)二氧化碳能使澄清的石灰水变浑浊,是因为二氧化碳和石灰水中的氢氧化钙反应生成了碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
二氧化碳与氢氧化钠反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;
其中方案二不能证明二氧化碳确与氢氧化钠反应了,理由是:二氧化碳能够溶于水,导致塑料瓶中压强减小,从而导致塑料瓶变瘪.
故填:CO2+Ca(OH)2=CaCO3↓+H2O;CO2+2NaOH=Na2CO3+H2O;二;二氧化碳能够溶于水,导致塑料瓶中压强减小,从而导致塑料瓶变瘪.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源:2017届甘肃省张掖市九年级下学期期中考试化学试卷(解析版) 题型:简答题
下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B黑色固体,下图是它们之间的相互转化关系。请回答:

(1)写出下列物质的化学式:A._____________B__________________。
(2)得到F溶液的操作Ⅰ的名称为:________________。
(3)请写出E →F的化学方程式:______________________________________。
(4)请写出G →I的化学方程式:______________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 干冰用于人工降雨--干冰易升华同时吸收大量的热 | |
| B. | 一氧化碳用于冶金工业--一氧化碳能够燃烧 | |
| C. | 金刚石用于裁玻璃--金刚石很硬 | |
| D. | 石墨用于制铅笔芯--石墨很软 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 配置溶液时,只能用水做溶剂 | |
| B. | 氯化钠溶于水时,溶液温度升高 | |
| C. | 酒精跟水以任意比互相溶解时,酒精做溶质,水做溶剂 | |
| D. | 乳化就是溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com