
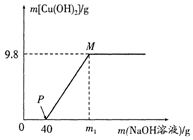
 向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2. 据图回答:
向含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2. 据图回答:分析 (1)根据复分解反应的实质生成沉淀 气体或水时离子数目减少,没参与反应的离子数目不变分析
(2)根据整个反应过程的生成物及反应物来判断
(3)M点溶液中的溶质是氯化钠,氯化钠有两部分,一是盐酸与氢氧化钠生成的,另一部分是氯化铜和氢氧化钠反应生成的.溶液质量可用质量守恒法来求,加入的混合溶液的总质量+氢氧化钠溶液的质量-生成的氢氧化铜沉淀的质量.从而求出溶液中溶质质量分数.
(4)已知氯化铜和氢氧化钠生成氢氧化铜沉淀的质量可求出反应的氢氧化钠的质量,盐酸和氯氧化钠反应消耗的氢氧化钠溶液质量为40g,可求出整个过程中消耗的氢氧化钠溶液的质量.
解答 解:(1)CuCl2和HCl的混合溶液中,逐滴加入NaOH溶液,氯化氢先与氢氧化钠反应生成氯化钠和水,然后氯化铜再与氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:NaOH+HCl═NaCl+H2O;CuCl2+2NaOH═Cu(OH)2↓+2NaCl,由化学方程式可以看出,在此整个过程中,氯离子数目不变.
(2)P点表示氯化氢和氢氧化钠恰好完全反应,此时氯化铜还没和氢氧化钠反应,故溶液中的溶质为NaCl CuCl2.
(3)设氯化氢与氢氧化钠反应生成氯化钠的质量为x
NaOH+HCl═NaCl+H2O
40 58.5
40g×10% x
$\frac{40}{40g×10%}=\frac{58.5}{x}$
x=5.85g
设生成9.8g氢氧化铜沉淀需氢氧化钠溶液的质量为y,生成氯化钠的质量为z
CuCl2+2NaOH═Cu(OH)2↓+2NaCl,
80 98 117
y×10% 9.8g z
$\frac{80}{y×10%}=\frac{98}{9.8g}=\frac{117}{z}$
y=80g; z=11.7g;
M点溶液中的溶质氯化钠的质量为11.7g+5.85g=17.55g
M点溶液的溶质质量分数=$\frac{17.55g}{100g+120g-9.8g}$×100%≈8.3%
答:M点溶液的溶质质量分数为8.3%
(4)氯化氢和氢氧化钠反应时消耗的氢氧化钠溶液的质量为40g,所以m1=40g+80g=120g
故答案为:(1)Cl-;(2)NaCl CuCl2;(3)8.3%;(4)120.
点评 本题考查化学方程式与溶液的综合计算,解题关键是分析清楚反应过程的先后,找出每个过程中已知物质的质量.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 过量的Fe粉与稀硫酸反应,过滤 | B. | 过量的Fe2O3与稀硫酸反应,过滤 | ||
| C. | 过量的稀硫酸与Fe2O3反应 | D. | Fe粉与过量的H2SO4溶液反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X>Z>Y | B. | X>Y>Z | C. | Y>Z>X | D. | Y>X>Z |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com