今有镁、锌两种金属混合物7.7g,与足量的稀盐酸充分反应,产生的气体能使12g氧化铜恰好被还原,求原混合物中镁、锌各自的质量.
【答案】
分析:①根据氢气含有氧化铜的化学方程式和氧化铜的质量,列出比例式,就可计算出与12g氧化铜反应的氢气的质量(即镁、锌两种金属混合物与足量的稀盐酸充分反应产生的气体质量);
②根据镁、锌分别与盐酸反应的化学方程式和已知条件列出含未知数的等式,就可计算出混合物中其中一种金属的质量,进而求出另一种金属质量.
解答:解:①设与12g氧化铜反应的氢气的质量为x,
CuO+H
2?Cu+H
2O
80 2
12g x
80:2=12g:x
解之得:x=0.3g;
②设原混合物中镁的质量为y,则锌的质量为7.7g-y,
Mg+2HCl=MgCl
2+H
2↑ Zn+2HCl=ZnCl
2+H
2↑
24 2 65 2
y m 7.7g-y n
∴m+n=

+
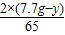
=0.3g,
解之得:y=1.2g,
则锌的质量为7.7g-1.2g=6.5g.
答:原混合物中镁的质量为1.2g;锌的质量为6.5g.
点评:本题主要考查学生灵活运用化学方程式进行计算的能力.学生需全面分析数量关系,正确运用化学方程式,才能正确解答.

 +
+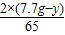 =0.3g,
=0.3g,
