
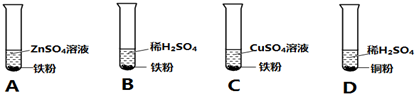
分析 ①根据金属与酸会盐能否发生反应,可以比较金属的活动性大小;
②根据金属与酸、盐的反应是反应物量的多少分析滤渣及滤液中含有的成分
解答 解:①通过A可以判断锌比铁活泼,通过B可以判断铁排在氢元素的前面,通过D可以判断铜排在氢元素的后面,即通过A、B、D可以判断出锌比铁活泼,铁比铜活泼,并且锌和铁排在氢元素的前面,铜排在氢元素的后面,因此省略C实验也能达到目的.
故答案为:C.
②向所得滤液中加入铁粉,若无气泡产生时.
A、由于锌、铁、铜三种金属中锌的活动性最强,硫酸锌不会和其他物质反应,所以滤液中一定有硫酸锌;故正确;
B.滤液中可能有硫酸铜,如果铁的量不足,则滤液中有硫酸铜,故正确;
C.滤渣中不一定含有Fe,如果铁和其它物质反应时不足,或恰好完全反应,则滤渣中不含有Fe,故错误;
D、由于锌的活动性比铁强,铁不能把锌从硫酸锌溶液中置换出来,故滤渣中肯定没有锌;故错误;
故答案为:AB.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 主食 | 米饭 |
| 副食 | 红烧牛肉、花生米、清蒸鱼 |
| 饮料 | 牛奶 |
| A. | (1)(2)(4) | B. | (2)(4)(5) | C. | (1)(3)(4) | D. | (1)(2)(4)(5) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaCl、BaCl2、CuSO4、KNO3 | B. | NaCl、Na2CO3、KNO3、KCl | ||
| C. | NaOH、FeCl3、MgSO4、KCl | D. | Ba(NO3)2、NaCl、H2SO4、HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com