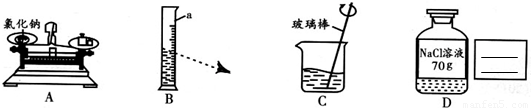
解:
(1)70g20%的氯化钠溶液中溶质氯化钠的质量为70g×20%=14g.在称量过程,调平托盘天平后,将砝码和游码设定为14g,之后慢慢加入氯化钠到天平平衡,而不能在动砝码和游码.当出现右侧偏高(左物右码,右侧为砝码一侧),说明加入的氯化钠过量,因此需要减少左盘的食盐.
(2)本实验需要用到的水的质量为70g-14g=56g,其体积为56mL.对于液体,需要用量筒量取.在量取过程中,视线要一直盯着刻度56,且是水平于凹液面的.所以当如图所示读数时,会导致量取的液体偏多,由于溶剂增大,所以会导致溶液的溶质的质量分数偏小.
(3)在溶解过程中,用玻璃棒打破固体附近的饱和状态,进而加速物质的溶解.所以玻璃棒的作用是搅拌,目的是加速溶解.
(4)溶液的试剂瓶的标签应该体现名称和质量分数,而无需体现溶液质量.(标注的是过程中不能变化的内容).
故答案为:
(1)14; ⑥;(2)量筒;偏小;(3)搅拌;(4)

分析:溶液配制过程,用固体作为溶质时,分为4步:计算---称(固体)量(液体)--溶解--装瓶贴标签.
(1)称量前要先计算,称量时先将调平的天平的砝码和游码设置为要达到的数值(本题为14),之后的称量过程不能在动砝码和游码(这个和称量一个物品的质量恰好相反).
(2)量取液体时,视线要与凹液面最低处保持水平,由于需要的水的体积是确定的,所以开始视线就是盯着刻度的,当仰视时,实际加入的液体的体积大于目标数值.
(3)在溶解过程,玻璃棒的作用是搅拌,目的是加速溶解.
(4)对于溶液的标签,体现的是名称和质量分数,而不是溶液的质量(因为使用过程中溶液的质量会发生改变).
点评:称取一定量的药品时,中间过程不能再次移动砝码和游码.称取物品的质量时,过程中只能动砝码和游码.这两者的目的不同,操作也就不同.




 (2013?红桥区二模)某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.
(2013?红桥区二模)某实验室欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品.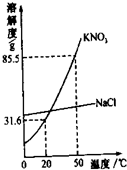 某实验室欲配制一定溶质质量分数的硝酸钾溶液,现实验室只有含少量NaCl的硝酸钾固体药品.
某实验室欲配制一定溶质质量分数的硝酸钾溶液,现实验室只有含少量NaCl的硝酸钾固体药品.