
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |

| ||
21%×
| ||||
| 1L |
| ||


科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 高温高压 |
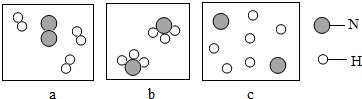
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 操作步骤 | 现象记录 | 反应的化学方程式 |
| 取两支试管,分别往试管中加入2mL样品1、2,再往其中滴入盐酸 | 样品1:无明显现象 | NaOH+HCl=NaCl+H2O NaOH+HCl=NaCl+H2O |
| 样品2:溶液中出现气泡 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑ |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
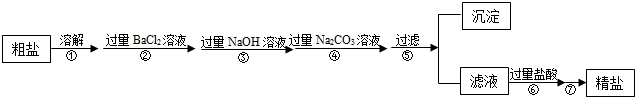
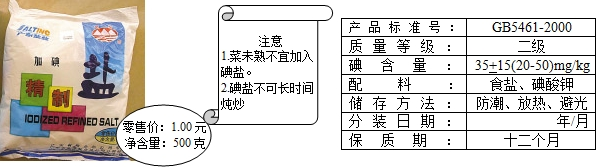
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com