
【题目】黄铜(铜和锌的合金)外观与黄金十分相似,但黄铜在潮湿的空气中长时间放置会产生铜绿,而黄金就不会。某化学兴趣小组的同学,对一件生满了铜绿的制品展开了探究活动。
[实验探究]①用小刀刮下铜绿,放入隔绝空气容器内加热,生成了黑色固体氧化铜、水和使澄清石灰水变浑浊的无气味气体。
②取一小块表面有铜绿的黄铜片放入稀硫酸中(如下图A),观察到有气泡产生,溶液变蓝。通过实验探究①可知铜绿的成分中由_____种元素组成。
[提出问题1 ]实验探究②中生成的气体是什么?
[猜想与假设]
假设一:生成的气体是CO2
假设二:生成的气体是H2
假设三:生成的气体是_______
[实验验证]
同学们又连接了如下图所示的装置进行验证:
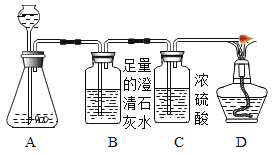
A中反应较长时间后,再点燃D处的酒精灯。观察到________现象,则证明假设三成立。若在A的样品中加入稀硫酸后,立即点燃D处的酒精灯,可能造成的结果是________。
[提出问题2] A中反应后溶液呈蓝色,其中溶质有哪些?
某同学认为蓝色溶液中可能含有CuSO4和H2SO4。
[实验验证]为证明蓝色溶液中可能存在CuSO4和H2SO4,同学们进行了如下实验。
实验操作 | 实验现象 | 实验结论 |
取少量蓝色溶液于试管中,加入过量打磨过的锌片 | ____ | 溶质中一定含有H2SO4 |
_____ | 溶质中一定含有CuSO4 |
你认为上述反应后溶液中还存在的金属离子是_______(写离子符号)。
[拓展提升]
有不法分子用黄铜冒充黄金行骗,请你再设计另外两种方法,辨别真假黄金。
序号 | 方法 | 现象 | 结论 |
1 | _____ | _____ | 为假黄金 |
2 | _____ | _____ |
【答案】四 CO2和H2 B中澄清石灰水变浑浊,D处气体燃烧产生淡蓝色火焰 发生爆炸 有气泡产生 有红色物质析出, 蓝色溶液逐渐变成无色 Zn2+ 取样,空气中灼烧 表面变黑并擦拭不掉 取样,放入硝酸银溶液中 溶液变蓝,样品表面有银白色固体物质生成
【解析】
[实验探究]
通过实验探究①,用小刀刮下铜绿,放入试管内加热,生成了黑色固体氧化铜、水和使澄清石灰水变浑浊的无气味气体,则该气体为二氧化碳,根据质量守恒定律,可知铜绿的成分中由铜、氢、氧、碳四种元素组成。
[猜想与假设]
可能是二氧化碳和氢气均有,故假设三:生成的气体是CO2和H2。
[实验验证]
A中反应较长时间后,再点燃D处的酒精灯,若观察到B中澄清石灰水变浑浊,D处气体燃烧产生淡蓝色火焰现象,说明生成气体中含有二氧化碳和氢气,则证明假设三成立,氢气不纯时点燃可能发生爆炸,若在A的样品中加入稀硫酸后,立即点燃D处的酒精灯,可能造成的结果是发生爆炸。
[实验验证]
为证明蓝色溶液中可能存在CuSO4和H2SO4,取少量蓝色溶液于试管中,加入过量打磨过的锌片,锌片与稀硫酸反应生成硫酸锌和氢气,与硫酸铜溶液反应生成红色的铜和无色的硫酸锌溶液,故有:
实验操作 | 实验现象 | 实验结论 |
取少量蓝色溶液于试管中,加入过量打磨过的锌片 | 有气泡产生 | 溶质中一定含有H2SO4 |
有红色物质析出, 蓝色溶液逐渐变成无色 | 溶质中一定含有CuSO4 |
上述反应后溶液中还存在的金属离子是锌离子,符号为Zn2+。
[拓展提升]
加热条件下,铜与氧气反应生成红色氧化铜,铜与硝酸银溶液反应生成蓝色硝酸铜溶液和银白色的银;故有:
序号 | 方法 | 现象 | 结论 |
1 | 取样,空气中灼烧 | 表面变黑并擦拭不掉 | 为假黄金 |
2 | 取样,放人硝酸银溶液中 | 溶液变蓝,样品表面有银白色固体物质生成 |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】根据下列实验装置图回答问题:
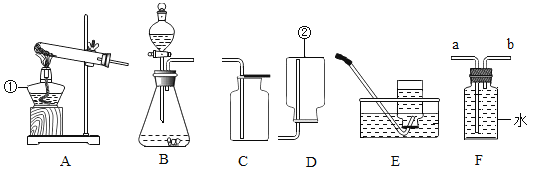
(1)图中标号仪器名称:①_____。
(2)写出实验室用固体纯净物制取氧气的文字表达式:_____;用该方法制取并测量收集氧气的体积,所需上述装置中的_____(填字母序号),同时还需要补充一些仪器和物品,其中的一种玻璃仪器名称是_____。
(3)如图是氧气与三种物质发生反应的实验描述,正确的是_____(填字母序号)。
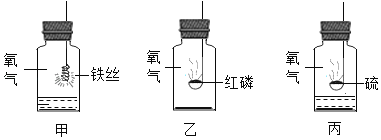
A 三者燃烧现象描述:甲中会生成黑色固体,乙中会生成白色固体,丙中会产生蓝紫色火焰。
B 三者既是化合反应也是氧化反应。
C 三者生成物都为是固体
D 甲中水可用细沙代替
E 可以用铁丝、硫粉代替红磷做测定空气中氧气含量实验
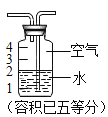
(4)探究木条复燃与氧气体积分数的关系:
某同学用如图装置研究了木条复燃与氧气体积分数的关系,发现不纯的氧气也能使带火星的木条复燃。如图是他其中一次实验的装置,排尽水收集氧气后集气瓶中氧气的体积分数是_____ (精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化合物中某一种元素的原子短缺可形成非整比化合物,这类化合物中各类原子的相对数目不能用简单整数比表示,如Fe0.9O、PbO1.9等。非整比化合物是新型的功能材料,具有很大的科技价值。
(1)PbO1.9中铅元素具有+2、+4 两种价态,其中+4 价铅占铅总量的_______。
(2)如图所示,Fe0.9O可用于CO2的综合利用。
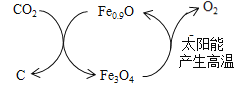
①请写出该转化的两个优点:___________、__________。
②若用1mol Fe0.9O与足量的CO2完全反应可生成_g C(碳)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲醛(CH2O) 为无色有刺激性气味的气体,极易溶于水,是重要的工业原料。由于甲醛影响人体健康,国家标准规定室内甲醛浓度不高于0.08 mg/m。下面介绍几种吸收甲醛的方法。
活性炭包活性炭内部有大量细微孔道,可吸附甲醛。
空气净化器其内置主要有电机和滤网。电机可加快抽入气体的循环流动速度。滤网除活性炭滤网外,还有静电驻极过滤网、光触媒滤网等。静电驻极过滤网靠静电力捕获带电微粒,但不能捕获甲醛。光触媒滤网在紫外线照射下产生氧化能力极强的物质,该物质可杀菌和分解甲醛等有机污染物。
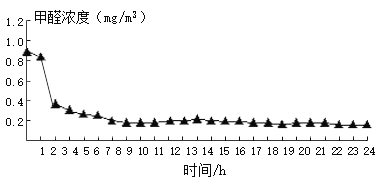
植物某小组在3个密闭容器内分别放入吊兰、绿萝和芦荟,测定0 ~ 24 h甲醛的浓度,计算不同植物对甲醛的去除率(见表),比较其吸收效果,并绘制了吊兰的吸收曲线(如图)。柚子皮和菠萝不具有吸附性,也不与甲醛反应,常温下只能靠自身的气味掩盖甲醛的味道。
吊兰 | 绿萝 | 芦荟 | |
0 h时甲醛的 浓度(mg/m3) | 0.88 | 0.80 | 1.13 |
24 h时甲醛的 浓度(mg/m3) | 0.13 | 0.07 | 0.19 |
去除率(%) | 85.2 | 91.3 | 83.2 |
以上方法效果不一,可根据不同情况选用适合的方法。
依据文章内容,回答下列问题。
(1)甲醛(CH2O) 属于______(填序号,下同)。
A 混合物
B 化合物
C 氧化物
(2)空气净化器吸收甲醛比活性炭包效率高的原因是______(答1条即可)。
(3)依图分析,吊兰吸收效率最高的时间是______。
A 0 ~ 1 h
B 1 ~ 2 h
C 7 ~ 8 h
(4)依表判断,吸收效果最好的植物是______。
(5)下列说法正确的是______。
A 甲醛是重要的工业原料,但使用时需考虑其对环境的影响
B 空气净化器的每层滤网都可以吸收甲醛
C 本实验中,3种植物都不能使密闭容器内甲醛含量降低至国家标准以下
D 柚子皮和菠萝吸收甲醛的效果较好
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年12月16日,我国在西昌卫星发射中心,以“一箭双星”方式成功发射第52、53颗北斗导航卫的星。一种新型火箭推进剂在发射过程中,发生反应的微观示意图如下图。下列说法正确的是
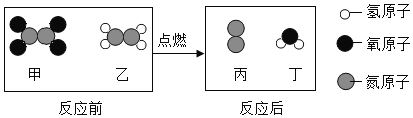
A.化学反应都是放热的,只是放出热量的多少不同
B.该反应生成丙和丁的分子个数比为3:4
C.甲物质是由2个氮原子和4个氧原子构成
D.该反应前后原子的数目发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液与人类生产、生活密切相关。
(1) A、B、C三种固体物质的溶解度曲线如图所示。
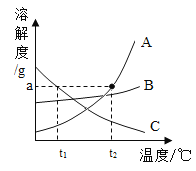
①t1°C时,A、B、C三种物质的溶解度由大到小的顺序是____________________。
②t2°C时,完全溶解agA物质最少需要水的质量是______________g。
③t2°C时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量____________B的饱和溶液中所含水的质量(填“大于”、“等于” 或“小于”)。
(2)将45g10%的氯化钠溶液配成为0.9%的氯化钠溶液,得到氯化钠溶液的质量是______________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验: (电子秤示数单位为克)
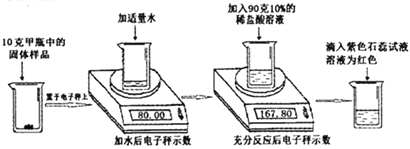
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈____性。
(2)上述实验中产生的二氧化碳气体质量为______克。
(3)计算甲瓶固体样品中碳酸钠的质量分数____________。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。

(查阅资料)
常温下镁粉能与水发生置换反应,且放热。
(进行实验)
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
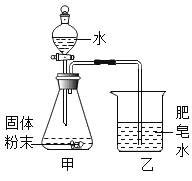
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ? | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
(解释与结论)
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2↑
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
(反思改进)
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的实验方案为:取少量固体混合物___________________。
(6)从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组发现实验室中有一包被硫酸镁和氯化钙污染的氯化钠固体。为了除去杂质,得到纯净的氯化钠。他们设计了下如下实验方案:( )
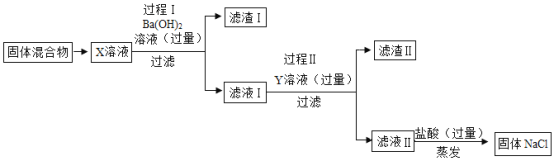
A.Y是K2CO3
B.向滤液Ⅱ中滴加1滴盐酸溶液,溶液无明显变化,是因为Y溶液过量。
C.过程Ⅰ和过程Ⅱ中添加的除杂试剂可以互换。
D.假设整个操作过程中物质转化无损失,则最后得到固体中NaCl的质量和原样品中NaCl的质量大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com