
【题目】某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。小青同学设计了以下实验方案来除去可溶性杂质。
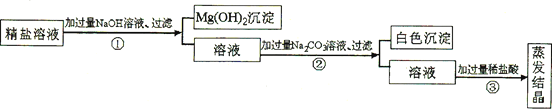
(1)步骤①的化学方程式为___________。
(2)步骤②中得到的白色沉淀是_________(填化学式)。
(3)步骤③中加稀盐酸是为了除去溶液中的______。
A CaCl2 B MgCl2 C NaOH D Na2CO3
【答案】2NaOH+MgCl2=2NaCl+Mg(OH)2↓ CaCO3 CD
【解析】
除钙离子用碳酸根离子,除镁离子用氢氧根离子,加入的试剂都是过量的,后加的试剂要把先加的试剂所带入的杂质除掉,加入过量的稀盐酸,这样可以除去多余的碳酸根离子和氢氧根离子
(1)步骤①的反应是氢氧化钠和氯化镁生成氢氧化镁和氯化钠,反应的化学方程式为2NaOH+MgCl2=2NaCl+Mg(OH)2↓。
(2)步骤②反应是碳酸钠和氯化钙生成碳酸钙和氯化钠,得到的白色沉淀是碳酸钙,化学式为CaCO3。
(3) 加适量盐酸,与①中过量NaOH溶液和②中过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体;蒸发、结晶,得到精盐,步骤③中加稀盐酸是为了除去溶液中的氢氧化钠和碳酸钠,故选CD。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:
【题目】某矿石主要成分是 MgO,含少量的 Fe2O3、CuO 和 SiO2 杂质。用该矿石制备 Mg(OH)2 的工艺流程简图如图:

回答下列问题:
(1)步骤①和步骤②均用到的操作是_____________;
(2)步骤①中加过量稀盐酸的目的是______________;
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的 pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的 pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的 pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的 pH 范围为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的运用。下图为自来水厂净水过程示意
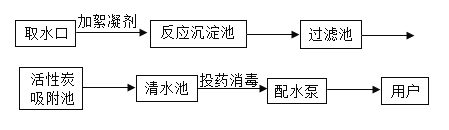
(1)上图吸附池内的活性炭起_______作用,经沉淀、过滤等净化处理后所得的水_______纯水(填“是”或“不是”).
(2)自来水厂常用的消毒剂有二氧化氯(ClO2)、漂白粉、“84消毒液”等。工业上制取漂白粉的化学方程式为2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,制取“84消毒液”是将氯气通入烧碱(NaOH)溶液中得到,反应原理与漂白粉的制取相似,请写出该反应的化学方程式:___________。
(3)家庭生活中可以用_______检验某水样是硬水还是软水。
(4)有些科学家预言:“世界上最后一滴水就是人类的眼泪”。这句话警示我们应树立保护水资源的意识:一是节约用水,二是防止水体污染.请你举一例节约用水的做法:__________(合理答案均可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
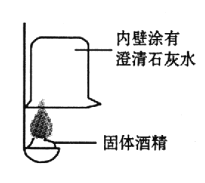
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生______________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
(提出问题)白色固体是什么物质?
(做出猜想)小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:___________________;猜想三:Ca(OH)2。
他的依据是______________________________________________________________。
(交流反思)经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:
________________________________________________________________________。
(进行实验)
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到____________________,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液,______________________________,有白色沉淀出现,证明猜想三成立。该反应的化学方程式为:
________________________________________________________________________。
结论:白色固体是Ca(OH)2。
(拓展应用)已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是___________(选填图中装置序号)。
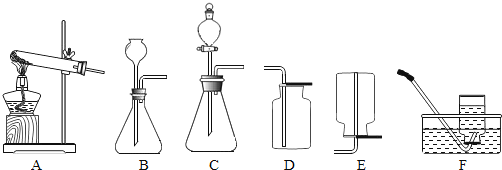
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图中A~H是初中化学常见的物质。A俗称纯碱;C可用作补钙剂; G是一种常见的氮肥,含氮量为35%; H、F物质类别相同。图中“一” 表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。

(1)写出化学式: A______,H________。
(2)B和G反应的化学方程式_______,此反应现象为___。E和C反应的化学方程式________________。
(3)若E与G的组成元素相同,则E属于___。(填“酸”或“碱”或“盐”或“氧化物”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习《制取氧气》时,小明突发奇想:除了书上介绍的三种原理,是否可以用其他药品来制得氧气呢?对此,他带领学习小组进行了以下探究。
针对小明的突发奇想,这属于科学探究的_____环节。小组同学求助老师得知,可以用一些过氧化物如过氧化钠、过氧化钙等进行试验。
〖提出问题〗过氧化钙可否用于制取氧气。
〖查阅资料〗部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,同时得到氧化钙。当与水接触时,也能生成氧气,同时得氢氧化钙。可做鱼池增氧剂、泳池杀菌剂等。
〖猜想与验证〗
(1)猜想Ⅰ:加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①检验装置的气密性。操作如下:先将导管一段伸入液面以下,用手紧握试管,观察到_____,松手后,_____。 ②加入过氧化钙,加热,试管口略向下倾斜的原因是_____,导管口有大量的气泡冒出。 ③收集满一瓶气体。验满的方法是_____。 ④停止加热。熄灭酒精灯前,应先_____。 ⑤检验气体。方法是_____。 |
实验结论:加热过氧化钙可制取氧气。反应的文字表达式为_____,基本反应类型为_____。
(2)猜想Ⅱ:过氧化钙与水反应可迅速制取大量氧气。
实验装置 | 实验主要过程 |
| ①检验装置的气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,振荡试管后,仍有少量的细小气泡缓慢放出。收集并检验所得气体,确为氧气。 |
实验结论:不能用过氧化钙与水反应迅速制取大量氧气。
分析与反思:
①虽然没有快速收集到大量氧气,但渔民用过氧化钙做增氧剂的原因是_____。
②学习小组希望对此实验进行改进,使该反应加快。你的合理的建议是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用氨气(NH3)制取硝酸(HNO3)的工业流程为:
![]()
涉及的化学方程式为:
①![]() ;
;
②![]() ;
;
③![]() ;
;
(1)在上述反应涉及的NO、NO2、HNO3三种物质中任选其中一种物质标出该物质中所有元素的化合价________;
(2)反应③中X的化学式是________;
(3)在此制取过程中可以循环使用的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com