向20g 硫酸钠和碳酸钠的混合物中加入135.4g水,待固体全部溶解后,向所得溶液中滴加硫酸溶液,直到不再产生气体为止(假设气体全部逸出),共用去49g质量分数为20%的硫酸溶液.求:
(1)生成二氧化碳气体的质量;(2)原混合物中碳酸钠的质量分数;(3)反应后所得溶液中溶质的质量分数.______.
【答案】
分析:(1)硫酸钠和碳酸钠的混合物中碳酸钠与硫酸反应放出二氧化碳气体,根据反应的化学方程式,利用反应消耗硫酸的质量可求得生成二氧化碳的质量;
(2)根据反应化学方程式,由反应消耗硫酸的质量可计算混合物中碳酸钠的质量,而求得原混合物中碳酸钠的质量分数;
(3)反应后所得溶液为硫酸钠溶液,此时溶液中溶质硫酸钠由原混合物中硫酸钠及反应生成硫酸钠两部分组成,因此,需要利用化学方程式计算出反应生成硫酸钠的质量,然后再利用质量守恒定律计算出反应后溶液质量,即可解决反应后所得溶液中溶质的质量分数的计算.
解答:解:设反应生成二氧化碳的质量为x,消耗碳酸钠的质量为y,生成硫酸钠的质量为z
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 98 142 44
y 49g×20% z x
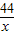
=
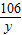
=
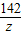
=
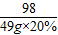
x=4.4g,y=10.6g,z=14.2g
(1)生成二氧化碳的质量=4.4g
(2)原混合物中碳酸钠的质量分数=
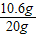
×100%=53%
(3)反应后所得溶液中溶质的质量分数=
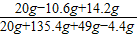
×100%=11.8%
答:(1)生成二氧化碳的质量为4.4g;(2)原混合物中碳酸钠的质量分数为53%;(3)反应后所得溶液中溶质的质量分数为11.8%.
点评:根据质量守恒定律,反应质量所得溶液质量=固体混合物的质量+溶解所用水的质量+所加入稀硫酸的质量-反应放出二氧化碳的质量.

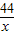 =
=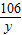 =
=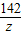 =
=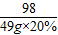
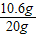 ×100%=53%
×100%=53%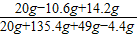 ×100%=11.8%
×100%=11.8%

 名校课堂系列答案
名校课堂系列答案